题目内容
【题目】按要求回答下列问题:
(1)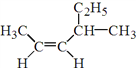 的名称是______________________________。
的名称是______________________________。
(2)![]() 中官能团的名称为______________,该物质与足量NaOH(aq)反应的化学方程式是___________________________,
中官能团的名称为______________,该物质与足量NaOH(aq)反应的化学方程式是___________________________,![]() 转化为
转化为![]() 所用试剂是________________(填化学式)。
所用试剂是________________(填化学式)。
(3)检验CH2=CHCHO中含有醛基的试剂是_______________(写一种即可),反应的化学方程式是__________________________________________。
(4)苯乙烯是一种重要的化工原料,合成苯乙烯的流程如下(A、B、C、D均为有机化合物):
 反应2的类型是____________________, 反应1的化学方程式是__________________,反应3的化学方程式是_______________________________________。
反应2的类型是____________________, 反应1的化学方程式是__________________,反应3的化学方程式是_______________________________________。
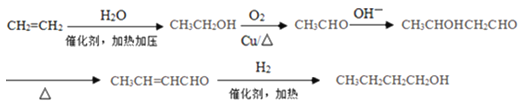
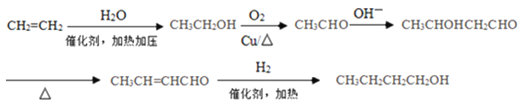
(5)写出由CH2=CH2合成CH3CH2CH2CH2OH的流程(无机试剂任选)_____。

(流程图示例:![]() )。
)。
【答案】 顺—4—甲基—2—己烯 羟基、羧基 ![]() NaHCO3 银氨溶液或新制氢氧化铜
NaHCO3 银氨溶液或新制氢氧化铜 ![]()
或![]() 加成反应
加成反应 ![]()
![]()
【解析】(1)该有机物为烯烃,包含碳碳双键在内的最长碳链有6个碳,主链为己烯;编号从距离碳碳双键最近的一端开始,碳碳双键在2号C,4号C上有1个甲基;顺式结构,则该物质的名称为:顺—4—甲基—2—己烯;
(2)①![]() 中含有1个酚羟基,1个醇羟基,1个羧基;
中含有1个酚羟基,1个醇羟基,1个羧基;
②酚羟基和羧基均能与NaOH发生反应,反应方程式:![]() ;
;
③酸性:羧基>碳酸>酚羟基,根据“强酸制弱酸”原理,![]() 中只有-COOH能与NaHCO3反应,且生成二氧化碳,故将
中只有-COOH能与NaHCO3反应,且生成二氧化碳,故将![]() 转化为
转化为![]() ,可选择NaHCO3。
,可选择NaHCO3。
故答案为:羟基、羧基;![]() ;NaHCO3;
;NaHCO3;
(3)可以利用醛基的特征反应来检验醛基:银镜反应、与新制的氢氧化铜反应,故所需试剂为:银氨溶液或新制氢氧化铜。银镜反应方程式为:![]() ;与新制氢氧化铜反应方程式为:
;与新制氢氧化铜反应方程式为:![]() 。
。
(4)由A→B的反应条件及“![]() ”,可知A为卤代烃,则反应1为苯的卤代反应,一般用液溴与苯发生取代反应,A为
”,可知A为卤代烃,则反应1为苯的卤代反应,一般用液溴与苯发生取代反应,A为![]() ;反应1的化学方程式为:
;反应1的化学方程式为:![]() ;B为
;B为![]() ,根据“
,根据“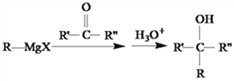 ”可知反应2为加成反应;B与苯乙烯相差2个碳原子,则D为
”可知反应2为加成反应;B与苯乙烯相差2个碳原子,则D为![]() ;B+D→
;B+D→![]() ;
;![]()
![]()
![]() ;所以C为
;所以C为![]() ,C在浓硫酸的条件下发生消去反应得到苯乙烯,反应3的方程式为:
,C在浓硫酸的条件下发生消去反应得到苯乙烯,反应3的方程式为:![]() 。
。
故答案为:加成反应;![]() ;
;![]() 。
。
(5)根据CH3CH2CH2CH2OH的碳原子数,及已知信息可知,先由2分子醛进行信息中的加成反应,获得含有4个碳原子的碳的骨架,再进行官能团的转化。CH2=CH2转化为醛分两步,CH2=CH2与H2O发生加成反应得CH3CH2OH,CH3CH2OH催化氧化得CH3CHO;根据已知信息,2分子CH3CHO在OH-环境下发生加成得到CH3CHOHCH2CHO;加热,CH3CHOHCH2CHO发生消去反应生成CH3CH=CHCHO或CH2=CHCH2CHO,再与H2加成得到目标产物CH3CH2CH2CH2OH。流程可表示如下:

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】在2 L密闭容器内,t℃时发生反应:N2(g)+3H2(g)![]() 2NH3(g),在体系中,n(N2)随时间的变化如下表:
2NH3(g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)上述反应在第5min时,N2的转化率为_______________________;
(2)用H2表示从0~2 min内该反应的平均速率v(H2)=_____________;
(3)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为______________。(用字母填空,下同);
a.v(NH3)=0.05 mol·L-1·min-1 b.v(H2)=0.03 mol·L-1·min-1
c.v(N2)=0.02 mol·L-1·min-1 d.v(H2)=0.00 l mol·L-1·s-1
(4)下列表述能作为反应达到化学平衡状态的标志是_____________。
a.反应速率v(N2):v(H2):v(NH3)=1:3:2
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变
e.单位时间内生成n mol N2的同时,生成3n mol H2
f.v(N2)消耗=2v(NH3)消耗
g.单位时间内3mol H—H键断裂的同时2mol N—H键也断裂
【题目】碳酸钙可用作食品添加剂。以磷石膏(主要成分为CaSO4·2H2O)为原料制备碳酸钙的一种工艺流程如下:

(1)已知磷石膏“水洗”前后的部分杂质质量分数变化如下表:
SiO2 | P2O5 | Al2O3 | F- | Fe2O3 | |
水洗前/% | 9.21 | 3.08 | 0.55 | 0.68 | 0.19 |
水洗后/% | 8.96 | 1.37 | 0.46 | 0.29 | 0.27 |
则“水洗“除去的主要杂质是___________。
(2)气体A的化学式为_______。
(3)“碳化”时发生反应的化学方程式为____________。其他条件一定时,“碳化”反应中CaSO4的转化率随温度的变化如右图所示,温度高于45℃,CaSO4的转化率下降的原因是________。

(4)工业上电解(NH4)2SO4溶液可制取过二硫酸铵[(NH4)2S2O8],其中S2O82-的结构如下。电解时阳极的电极反应式为__________,过二硫酸铵可用于游泳池中水的消毒,其原因是_________。





