题目内容
将固体NH4Br置于密闭容器中,在某温度发生下列可逆反应:NH4Br(s)
NH3(g)+HBr(g)2HBr(g)
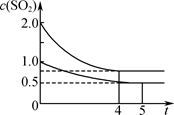
Br2(g)+H2(g).2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上述反应速率用v(NH3)表示,下列反应速率正确的是( )
| A.0.5mol/(L?min) | B.2.5mol/(L?min) |
| C.2mol/(L?min) | D.5mol/(L?min) |
根据反应可知,溴化铵分解生成的氨气浓度与溴化氢浓度相等,溴化铵分解生成的溴化氢的浓度为:c(HBr)+2c(H2)=4mol/L+2×0.5mol/L=5mol/L,
所以2min后溴化铵分解生成的氨气的浓度为:c(NH3)=c总(HBr)=5mol/L,
氨气的平均反应速率为:
=2.5 mol/(L?min),
故选B.
所以2min后溴化铵分解生成的氨气的浓度为:c(NH3)=c总(HBr)=5mol/L,
氨气的平均反应速率为:
| 5mol/L |
| 2min |
故选B.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
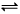 2C(g) ,下列关于该反应达到平衡状态的标志的说法中不正确的是
2C(g) ,下列关于该反应达到平衡状态的标志的说法中不正确的是 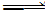 2SO3(g);ΔH=-197.74 kJ·mol-1。
2SO3(g);ΔH=-197.74 kJ·mol-1。