题目内容
某溶液中由水电离产生的C(H+)=1×10-10mol/L,该溶液的溶质不可能是( )
| A、KOH |
| B、Na2CO3 |
| C、HClO4 |
| D、Na HSO4 |
考点:水的电离
专题:电离平衡与溶液的pH专题
分析:常温下,水的离子积为1×10-14,由水电离产生的c(H+)等于10-10mol/L,说明该溶液中的溶质抑制了水的电离,该溶液为酸性或者碱性溶液,据此进行判断.
解答:
解:由水电离产生的c(H+)等于10-10mol/L,说明溶液中的溶质抑制了水的电离,
KOH、HClO4、NaHSO4都能电离出氢氧根离子或氢离子,抑制水的电离;而Na2CO3电离出的碳酸根离子结合水电离的氢离子,促进了水的电离,水的电离程度增大,故该溶液的溶质不可能是Na2CO3,
故选B.
KOH、HClO4、NaHSO4都能电离出氢氧根离子或氢离子,抑制水的电离;而Na2CO3电离出的碳酸根离子结合水电离的氢离子,促进了水的电离,水的电离程度增大,故该溶液的溶质不可能是Na2CO3,
故选B.
点评:本题考查水的电离及其影响因素,难度不大.注意酸碱溶液抑制水的电离,含有弱酸根或弱碱根离子的盐溶液促进水的电离.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式书写不正确的是( )
| A、NaHCO3溶液与过量的Ca(OH)2溶液反应:HCO3-+OH-+Ca2+=CaCO3↓+H2O |
| B、向1mol AlCl3溶液中加入2mol NaOH:Al3++4OH-=AlO2-+2H2O |
| C、铜片插入氯化铁溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| D、少量CO2通入NaOH溶液中:CO2+2OH-=CO32-+H2O |
下列有关铁元素的叙述中正确的是( )
| A、铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3 |
| B、氢氧化铁可以由相应的物质通过化合反应而制得 |
| C、氢氧化铁与氢碘酸反应:Fe(OH)3+3HI═FeI3+3H2O |
| D、铁元素位于周期表中第4周期第VIIIB族 |
下列说法正确的是( )
| A、硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| B、蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质 |
| C、Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 |
| D、碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物 |
桶烯(Barrelene)结构简式如图所示,有关说法不正确的是( )
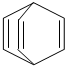

| A、桶烯分子中所有原子不可能在同一平面内 |
| B、桶烯在一定条件下能发生加成反应 |
| C、桶烯的分子式C8H8 |
| D、桶烯的一个氢原子被Cl取代,有四种结构 |
下列反应的离子方程式肯定不正确的是( )
| A、向硫酸铝铵[NH4Al(SO4)2]溶液中滴加Ba(OH)2溶液:NH4++Al3++2SO42+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3?H2O+2H2O | ||||
| B、向FeBr2溶液中通人Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | ||||
| C、向含Mg(HCO3)2的硬水中滴加NaOH溶液:Mg2++HCO3-+OH-=MgCO3↓+H2O | ||||
D、用惰性电极电解金属氯化物溶液的离子方程式:2Cl-+2H2O
|
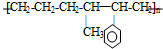 的单体的结构简式:
的单体的结构简式: