��Ŀ����
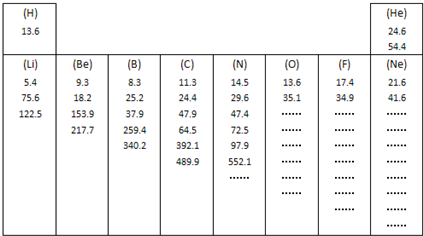
��10������Ԫ�صĸ������ʿɹ����������£����֣���
| Ԫ�� ���� | 8O | 16S | Se | 52Te |
| ���ʷе�(��) | -183 | 444��6 | 685 | 1390 |
| ��Ҫ���ϼ� | -2 | -2��+4��+6 | -2��+4��+6 |
|
| ԭ�Ӱ뾶��nm�� | 0��074 | 0��102 | 0��116 | 0��143 |
| ������H2��Ӧ | ��ȼ���� | ���Ȼ��� | �����ѻ��� | ����ֱ�ӻ��� |
�ش��������⣺
��1�������ӵĽṹʾ��ͼΪ �������ӵĵ���ʽΪ ��
��2���ڵ���Ҫ���ϼۿ����� ��
��3����Ԫ�ر������طǽ����� ����ǿ�����������û�ѧ����ʽ֤���ý��ۣ�
��4��H2O2���������ȼ�����������ˮ�е�Cl2��д���÷�Ӧ�Ļ�ѧ����ʽ��
(1) [ S ]2�� (2)��2.��+4��+6
(3)ǿ O2+2H2S=2S +2H2O (4)Cl2+H2O2=2HCl+O2
����:��1�������Ӵ�2������ɣ�����8�����ȶ��ṹ���ṹʾ��ͼΪ.�����Ӵ�2������ɣ�Ҳ����8�����ȶ��ṹ������ʽΪ
��
��2������ͬ����Ԫ���������ƣ����ƶ��ڵ���Ҫ���ϼۿ����У�2.��+4��+6��
��3���������õ��ʼ����û���֤����O2+2H2S=2S+2H2O��
��4��˫��ˮ�������������⣬�����л�ԭ�ԣ��ɱ������������Ӷ�����ˮ�е�����������ʽΪCl2+H2O2=2HCl+O2��

 Сѧ�̲�ȫ��ϵ�д�
Сѧ�̲�ȫ��ϵ�д� Сѧ��ѧ������ѿڶ���ϵ�д�
Сѧ��ѧ������ѿڶ���ϵ�д� ������Ӧ�������������ϵ�д�
������Ӧ�������������ϵ�д�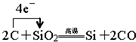
 ��2013?����ģ�⣩��һ��X��Y��Z��L��M����Ԫ�ص�ԭ��������������X����������Y���ڲ��������ȣ�Yԭ�ӵ������������Ǵ�����������������Z��L�ǿ����к������Ķ���Ԫ�أ�M�ǵؿ��к�����ߵĽ���Ԫ�أ��ش��������⣺
��2013?����ģ�⣩��һ��X��Y��Z��L��M����Ԫ�ص�ԭ��������������X����������Y���ڲ��������ȣ�Yԭ�ӵ������������Ǵ�����������������Z��L�ǿ����к������Ķ���Ԫ�أ�M�ǵؿ��к�����ߵĽ���Ԫ�أ��ش��������⣺ ��
��

 N2O4(g)����H��0���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ����ͼ��ʾ��
N2O4(g)����H��0���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ����ͼ��ʾ��

