题目内容
18.在298K、101×105 Pa下,将0.6mol CO2通入1mol•L-1NaOH溶液1000mL中充分反应,测得反应放出x kJ的热量.已知在该条件下,1mol CO2通入足量的NaOH溶液中充分反应放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(5x-2y)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(5y-2x) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(3x-y) kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ•mol-1 |
分析 根据题意可知,0.6molCO2通入1mol•L-1NaOH溶液1000mL中充分反应,测得反应放出akJ的热量,写出热化学反应方程式,再利用1mol CO2通入足量NaOH溶液中充分反应放出b kJ的热量写出热化学反应方程式,最后利用盖斯定律来书写CO2与NaOH溶液反应生成NaHCO3的热化学方程式.
解答 解:根据题意,0.6molCO2通入1mol•L-1NaOH溶液1000mL中充分反应,n(CO2)=0.6mol,n(NaOH)=1mol•L-1×1.0L=1mol,
该反应既生成碳酸钠又生成碳酸氢钠,方程式为3CO2+5NaOH═NaHCO3+2Na2CO3+2H2O,
由0.6molCO2反应放出热量为xKJ,则3molCO2反应放出热量为5xKJ,即热化学反应方程式为
3CO2(g)+5NaOH(aq)═NaHCO3 (aq)+2Na2CO3(aq)+2H2O(l)△H=-5xKJ/mol①,
又1mol CO2通入足量NaOH溶液中充分反应放出ykJ的热量,则热化学方程式为
2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l)△H=-yKJ/mol②,
由盖斯定律可知,①-②×2可得,NaOH(aq)+CO2(g)═NaHCO3(aq)△H=-(5x-2y)KJ/mol,
故选A.
点评 本题考查热化学方程式的书写和计算,是高考中常见题型,计算中涉及到化学方程式的有关计算问题和盖斯定律的有关应用,是一重点题型,学生还应注意在书写热化学方程式时标明各物质的状态,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol
反应过程中测定的部分数据如下表:
(1)反应0~2min末的平均速率v(COCl2)=0.1mol/(L?min).
(2)在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
(3)在表格中画出0~4min末n(COCl2)随时间的变化示意图图2
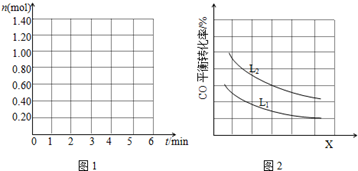
(4)已知X、L可分别代表温度或压强,如图2表示L一定时,CO的转化率随X的变化关系.X代表的物理量是温度;a<0 (填“>”,“=”,“<”),依据是因为X增大时,CO的平衡转化率降低,平衡逆向移动.
反应过程中测定的部分数据如下表:
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
(2)在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
(3)在表格中画出0~4min末n(COCl2)随时间的变化示意图图2

(4)已知X、L可分别代表温度或压强,如图2表示L一定时,CO的转化率随X的变化关系.X代表的物理量是温度;a<0 (填“>”,“=”,“<”),依据是因为X增大时,CO的平衡转化率降低,平衡逆向移动.
6.下列有关热化学方程式的叙述正确的是( )
| A. | 已知S(单斜,s)=S(正交,s)△H<0,则单斜硫比正交硫稳定 | |
| B. | HCl和NaOH反应的中加热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| C. | 已知S(g)+O2(g)═SO2(g)△H1<0;S(s)+O2(g)═SO2(g)△H2<0 则△H1<△H2 | |
| D. | 下列反应中,反应物的总能量E1与生成物的总能量E2一定相等$\stackrel{A+B}{反应物总能量{E}_{1}}$$\stackrel{发生反应A+B=C+D}{→}$$\stackrel{C+D}{生成物总能量{E}_{2}}$ |
7.下列离子方程式书写正确的是( )
| A. | 实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | 向NaHSO4溶液中滴加Ba(OH)2溶液至碱性:SO42-+2H++Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | NH4Cl浓溶液中滴加浓NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |