��Ŀ����
��a mL������Һ�еμ�0.01 mol��L��1������������Һ���ζ�������ͼ��ʾ��
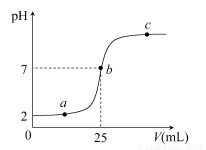
(1)������ҺŨ��________(������������С��������������)0.01 mol��L��1��������________��
(2)b�㣬c(Na��)________c(CH3COO��)(����>����<����������)
(3)������������������Һǡ����ȫ�к�ʱ�������϶�Ӧ�ĵ�QӦ��____��
A��2��a֮�� B��a��b֮��
C��b��c֮�� D��a��c֮��
(4)���й�ϵʽһ����ȷ����________��
A��a�㣬c(H��)>c(OH��)>c(CH3COO��)>c(Na��)
B��a�㣬c(Na��)>c(CH3COO��)>c(H��)>c(OH��)
C��c�㣬c(Na��)>c(CH3COO��)>c(OH��)>c(H��)
D��c�㣬c(Na��)��c(H��)��c(CH3COO��)��c(OH��)
(1)���ڣ�CH3COOH��������ʣ�ֻ���ֵ���
(2)����(3)C��(4)D
��������(1)��ʼʱ��������Һ��pH��2��c(H��)��0.01 mol��L��1�����ڴ�����������ʣ�������Һ�д���δ�����CH3COOH����c(CH3COOH)>0.01 mol��L��1��(2)b�㣬pH��7��ʾc(H��)��c(OH��)���ɵ���غ�ʽc(Na��)��c(H��)��c(OH��)��c(CH3COO��)�ó���c(Na��)��c(CH3COO��)��(3)CH3COOH��NaOH=CH3COONa��H2O������������������ǡ����ȫ�к�ʱ����Һ�ʼ��ԣ�pH>7�������϶�Ӧ��Q��Ӧ��b��c֮�䡣(4)a�㣬��Һ�������Ǵ���ʹ����ƣ���Һ�����ԣ����������ᣬ����Ũ�ȴ�С��ϵΪ��c(CH3COO��)>c(H��)>c(OH��)��������Һ�����ԡ����Ի���ԣ����ж�ֻ����Na����H����CH3COO����OH��������һ���е���غ�ʽ��Dѡ����ȷ��

 ��У����ϵ�д�
��У����ϵ�д���֪25��Cʱ��
����� | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
�ܶȻ� | 1.8��10��11 | 2.2��10��20 | 8.0��10��16 | 4.0��10��38 |
��ȫ����ʱ��pH | 9.7 | 5.0 | 5.5 | 4.0 |
�����ʵ��ᴿ�У����������ܵ���ʵij����ܽ�ƽ��ԭ����ȥijЩ���ӡ����磺
��Ϊ�˳�ȥ�Ȼ�茶����е��Ȼ������ʣ��Ƚ����������ˮ���ټ���һ�������Լ�a���з�Ӧ�����˽ᾧ���ɣ�
��Ϊ�˳�ȥ�Ȼ�þ�����е��Ȼ������ʣ��Ƚ����������ˮ���ټ���������������þ��ַ�Ӧ�����˽ᾧ���ɣ�
��Ϊ�˳�ȥ����ͭ�����е������������ʣ��Ƚ����������ˮ���ټ���һ������˫��ˮ������������������Ȼ������Լ�b������Һ��pH��4�����˽ᾧ���ɡ�
(1)�������ֳ��ӷ�������Fe2����Fe3��ת��Ϊ________(�ѧʽ)����ȥ��
(2)�Լ�aΪ________��
(3)д�����г������������ܷ�Ӧ�����ӷ���ʽ��________��
(4)�����뷽�����йص�������ȷ����________(����ĸ���)��
A��H2O2����ɫ�������������������в��������ʣ���������Ⱦ
B��������������������Ҫԭ����Fe(OH)2������Fe(OH)3�������ѹ���
C��������ҺpH��4���Լ�b��������ͭ������ͭ
D����pH����4����Һ��Fe3������ȫ������
25��Cʱ������ĵ���ƽ�ⳣ�����±���
���� | CH3COOH | HCN | H2CO3 |
Ka | 1.8��10��5 | 4.9��10��10 | K1��4.3��10��7 K2��5.6��10��11 |
�����й�˵����ȷ���� (����)
A�������ʵ���Ũ�ȵĸ���Һ��pH��ϵΪ��
pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B��a mol��L��1HCN��b mol��L��1 NaOH��Һ�������Ϻ�������Һ��c(Na��)>c(CN��)����aһ��С��b
C��������������μ�ˮ����Һ������������
D��NaHCO3��Na2CO3�Ļ��Һ�У�c(Na��)��c(H��)��c(OH��)��c(HCO3��)��2c(CO32��)

