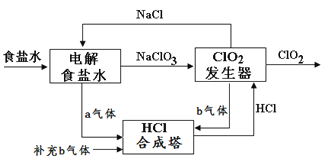
题目内容
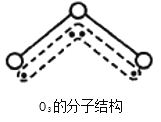
【题目】1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:
(1)选出下列分子与O3分子的结构最相似的的是___________。
A. H2O B.CO2 C.SO2 D.BeCl2
(2)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有___________对孤对电子。
(3)O3分子是_____________分子(填极性或非极性)。
(4)O3 能使淀粉碘化钾试纸变蓝2KI+O3+H2O===2KOH+I2+O2则氧化产物和还原产物的物质的量之比为____
【答案】 C 5 极性 1:2
【解析】试题分析:(1)根据臭氧分子结构进行分析;(2)根据孤对电子的概念及臭氧分子结构分析;(3)臭氧中的化学键都是非极性键;(4)根据氧化产物和还原产物的定义分析。
解析:(1)在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,使O3分子称折线形,在三个氧原子之间还存在着一个垂直于分子平面的大π键,这个离域的π键是由中心的氧原子提供两个p电子、另外两个配位氧原子各提供一个p电子形成的,SO2分子呈“V”字形结构,其成键方式与O3类似,S原子sp2杂化,S原子和两侧的氧原子除以σ键结合以外,还形成一个三中心四电子的大π键,
故选C;
(2)中间的氧原子含有1对孤电子对,两边的各含有2对孤电子对,所以总共5对孤电子对;(3)由于臭氧分子中的化学键都是非极性键,所以臭氧分子属于非极性分子;
(4) 2KI+O3+H2O===2KOH+I2+O2,KI中碘元素化合价升高被氧化为碘单质,碘单质是氧化产物,O3中氧元素化合价降低,被还原为KOH,KOH是还原产物,所以氧化产物和还原产物的物质的量之比为1:2。