题目内容
16.过碳酸钠(2Na2CO3•3H2O2)广泛用于洗涤、纺织、医疗、造纸等.某兴趣小组展开了深入的学习:【资料卡片】:
①过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解;
②过碳酸钠分解的化学方程式为2(2Na2CO3•3H2O2)$\frac{\underline{\;\;△\;\;}}{\;}$4Na2CO3+6H2O+3O2↑
③H2O2分解放出热量,Na2CO3受热不分解;
I、制备研究:工业上采用“醇析法”将其转化成固态的过碳酸钠晶体(化学式为2Na2CO3•3H2O2),“醇析法”的生产工艺流程如下:
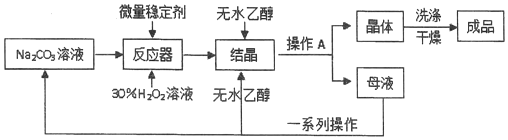
请回答问题:
(1)Na2CO3俗名:纯碱;其水溶液能使酚酞变红;
(2)H2O2受热容易分解,写出该分解反应的方程式:2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑;
(3)生产过程中,反应及干澡均需在低温度下进行,原因是H2O2和2Na2CO3•3H2O2受热都容易分解;
(4)生产过程中,加入较多无水乙醇后,过碳酸钠晶体大量析出,此无水乙醇的作用可能是无水乙醇能降低过碳酸钠溶解度;
(5)操作A的名称是过滤,若在实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒和漏斗;
(6)母液可以循环使用,但须进行“一系列操作”分离,这些操作包括:加入少里MnO2,不再有气泡产生后,过滤,将所得滤液再进行蒸馏(填操作名称),即可得Na2CO3溶液和95%的乙醇.为获取无水乙醇,还需进行的操作是:向95%的乙醇中加入足量CaO后,选A(填序号)装置进行实验.
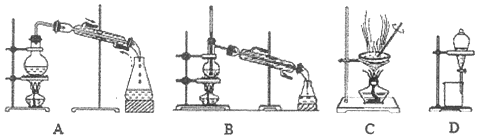
II、纯度测定:兴趣小组同学设计了如图1所示实验装置(部分仪器略去),测定过碳酸钠样品中2Na2CO3•3H2O2的质量分数.步骤如下:

①连接仪器并检查好气密性
②将过碳酸钠样品(2.20g)和少许MnO2均匀混合后置于装置A中,在量筒中加满水;
③连接仪器,打开滴液漏斗活塞,缓缓滴入水;
④待装置A中无气泡冒出(或无明显现象)时,停止滴加水,并关闭活塞;
⑤冷却至室温后,平视读数;
⑥根据数据进行计算.
请回答下列问题:
(7)完善实验步骤的相关内容:④无气泡冒出(或无明显现象);
(8)第⑤中,已“冷却至室温”的判断依据是:量筒内液面不再变化;
(9)量筒中,加装的长导管的作用是:防止冷却时,(短导管)将量筒中的水倒吸入A中影响测量;
(10)实验中,A,则开始收集气体;
A.刚开始出现气泡时
B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(11)量筒的局部示意见图2,平视读数时应沿b视线(选填“a”或“b”) 进行.图中b视线(选填“a”或“b”)对应的读数较大.
(12)若量筒中收集到气体的体积是224mL (己转化为标准状况下的数据),计算过碳酸钠样品中2Na2CO3•3H2O2的质量分数:95.0%;[Mr(O2)=32、Mr(2Na2CO3•3H2O2)=314]
(13)经过讨论,小组同学一致认为测定结果偏大,理由是当量筒中的液面高于水槽中的时,量筒内部气压小于外界大气压,使测量的气体体积偏大(任写一种).
分析 I、制备过碳酸钠,是在碳酸钠溶液中加入稳定剂和双氧水,可生成过碳酸钠,在溶液中加入无水乙醇,使过碳酸钠从溶液中析出,过滤得过碳酸钠晶体,经洗涤、干燥得成品,滤液经分离得碳酸钠溶液和无水乙醇,再循环利用,
(1)Na2CO3俗名为纯碱,其水溶液中碳酸根离子水解,能使溶液呈碱性;
(2)H2O2受热容易分解,生成水和氧气,据此答题;
(3)根据过碳酸钠不稳定,受热易分解考虑;
(4)过碳酸钠在乙醇中的溶解度较小,据此答题;
(5)根据不溶于液体的固体和液体分离的方法和过滤操作用到的仪器答题;
(6)母液里主要是过碳酸钠和乙醇,要使所含有的物质可以循环使用,要先将过碳酸钠分解得到碳酸钠,再进行蒸馏,可得Na2CO3溶液和95%的乙醇,将95%的乙醇变为无水乙醇,要向95%的乙醇中加入足量CaO后,再进行蒸馏,据此选择装置;
II、纯度测定:过碳酸钠在二氧化锰作催化剂的条件下能产生氧气,根据氧气的体积可计算出样品中过碳酸钠的质量,进而确定样品中过碳酸钠的质量分数,
(7)根据实验原理可知,要将过碳酸钠充分分解才能停止加水,过碳酸钠分解时有氧气产生,可以根据是否有气体产生判断过碳酸钠分解是否完全;
(8)根据装置图可知,当气体热胀冷缩时,量筒中液面会发生变化,据此判断;
(9)根据如果使用短导管造成的后果考虑;
(10)开始锥形瓶中有空气,最后锥形瓶中留有制取的气体考虑;
(11)读取量筒中液体体积时应使液体的凹液面与刻度线水平;量筒的小刻度在度部,而实验中量筒是倒置的,据此分析;
(12)根据题意,有关系式2(2Na2CO3•3H2O2)~3O2,根据量筒中收集到气体的体积可计算过碳酸钠样品中2Na2CO3•3H2O2的质量,进而确定其质量分数:
(13)根据装置图可知,当量筒中的液面高于水槽中的时,量筒内部气压小于外界大气压,使测量的气体体积偏大,会导致测得的氧气的体积偏大,据此分析.
解答 解:(1)Na2CO3俗名为纯碱,其水溶液中碳酸根离子水解,能使溶液呈碱性,所以其水溶液能使酚酞变红,
故答案为:纯碱;红;
(2)H2O2受热容易分解,生成水和氧气,反应的化学方程式为2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑;
(3)H2O2和2Na2CO3•3H2O2不稳定,受热易分解,所以生产过程中,反应及干澡均需在低温度下进行,防止其分解,
故答案为:H2O2和2Na2CO3•3H2O2受热都容易分解;
(4)过碳酸钠在乙醇中的溶解度较小,所以实验过程中用无水乙醇能降低过碳酸钠溶解度,
故答案为:无水乙醇能降低过碳酸钠溶解度;
(5)操作A为分离不溶于液体的固体和液体,所以操作A为过滤,过滤时用到的玻璃仪器是烧杯、玻璃棒和漏斗,
故答案为:过滤;漏斗;
(6)母液里主要是过碳酸钠和乙醇,要使所含有的物质可以循环使用,要先将过碳酸钠分解得到碳酸钠,再进行蒸馏,可得Na2CO3溶液和95%的乙醇,要使过碳酸钠分解,要加MnO2做催化剂,然后再过滤将二氧化锰除去,将95%的乙醇变为无水乙醇,要向95%的乙醇中加入足量CaO后,再进行蒸馏,所以要选择A装置,
故答案为:MnO2;蒸馏;A;
(7)根据实验原理可知,要将过碳酸钠充分分解才能停止加水,过碳酸钠分解时有氧气产生,可以根据是否有气体产生判断过碳酸钠分解是否完全,所以步骤④为待装置A中无气泡冒出(或无明显现象)时,停止滴加水,并关闭活塞,
故答案为:无气泡冒出(或无明显现象);
(8)根据装置图可知,当气体热胀冷缩时,量筒中液面会发生变化,所以第⑤中,已“冷却至室温”的判断依据是量筒内液面不再变化,
故答案为:量筒内液面不再变化;
(9)如果使用短导管由于温度降低后会使水沿着导管倒吸入锥形瓶内,所以量筒中长导管的作用是起缓冲作用,防止冷却时,(短导管)将量筒中的水倒吸入A中影响测量,
故答案为:防止冷却时,(短导管)将量筒中的水倒吸入A中影响测量;
(10)开始锥形瓶中有空气,最后锥形瓶中留有制取的氧气,两者体积相同,所以一开始就应当收集,故选A;
(11)读取量筒中液体体积时应使液体的凹液面与刻度线水平,所以平视读数时应沿b视线 进行,量筒的小刻度在度部,而实验中量筒是倒置的,所以图中b视线对应的读数较大,
故答案为:b;b;
(12)根据题意可知量筒中收集到气体的体积是224mL,即氧气的物质的量为0.01mol,设样品中的过碳酸钠的质量为Y则:
2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑
628 3mol
Y 0.01mol
根据:$\frac{628}{Y}=\frac{3}{0.01}$ 解得Y=2.09g,所以样品中2Na2CO3•3H2O2的质量分数为:$\frac{2.09}{2.20}$×100%=95.0%,
故答案为:95.0%;
(13)根据装置图可知,当量筒中的液面高于水槽中的时,量筒内部气压小于外界大气压,使测量的气体体积偏大,会导致测得的氧气的体积偏大,所以会使测定结果偏大,
故答案为:当量筒中的液面高于水槽中的时,量筒内部气压小于外界大气压,使测量的气体体积偏大.
点评 本题考查了过碳酸钠、碳酸钠的化学性质及有关溶液及化学方程式的计算,注重考查学生的分析能力和基本计算能力.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | 使用铁触媒,使N2和H2混合气体有利于合成氨 | |
| B. | 高压比常压条件更有利于合成氨的反应 | |
| C. | 700K左右比室温更有利于合成氨的反应 | |
| D. | 合成氨时采用循环操作,可提高原料的利用率 |
| A. | 用红色石蕊试纸检验溶液的酸性 | |
| B. | 用苯萃取碘水中的碘单质,液体分层,上层为紫红色 | |
| C. | 蒸馏时温度计的水银球应插在液面下 | |
| D. | 食用油和水分离,四氯化碳和水分离,均可用分液漏斗,且油层从下口流出 |
| A. | 某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A) | |
| B. | 0.2 mol•L-1 CH3COONa溶液与0.1 mol•L-1盐酸等体积混合后的酸性溶液中:>c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+) | |
| C. | 室温下,向100ml0.5mol/L的Na2CO3溶液中加入0.05molCaO,溶液中增大$\frac{c(O{H}^{-})}{c(H{{C}_{3}}^{-})}$ | |
| D. | 0.1 mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 |

下列说法正确的是( )
| A. | 有机物甲中共有两种化学环境下的氢 | |
| B. | 紫草宁的分子式为C16H18O5 | |
| C. | 紫草宁有8个不饱和度 | |
| D. | 在一定条件下,紫草宁可以发生氧化反应、还原反应、取代反应、加聚反应 |
| A. | 已知25℃时NH4CN水溶液显碱性,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN) | |
| B. | 25℃时,Mg(OH)2固体在20mL 0.01mol•L-1氨水中的KSP比在20mL 0.01mol•L-1NH4Cl溶液中的KSP小 | |
| C. | pH试纸测得新制氯水的pH为4.5 | |
| D. | NaHCO3溶液加热蒸干灼烧,得NaHCO3固体 |
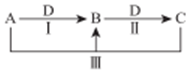 A、B、C、D 都是中学化学中常见物质,其中 A、B、C 均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D 都是中学化学中常见物质,其中 A、B、C 均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).