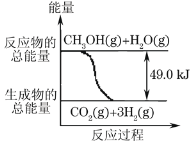
ћвƒњƒЏ»Ё
°Њћвƒњ°њ≤њЈ÷»хЋбµƒµзјл∆љЇв≥£ э»зѕ¬±н£Ї
»хЋб | HCOOH | HCN | H2CO3 |
µзјл∆љЇв≥£ э (25 |
|
|
|
ѕ¬Ѕ–—°ѕоінќуµƒ «( )
A.CN + H2O + CO2 °ъ HCN +HCO3©Б
B.2HCOOH + CO32©Б °ъ 2HCOO + H2O + CO2°ь
C.÷–ЇЌµ»ћеїэ°Ґµ»pHµƒHCOOHЇЌHCNѕыЇƒNaOHµƒЅњ«∞’яіу”ЏЇу’я
D.µ»ћеїэ°Ґµ»≈®ґ»µƒHCOONaЇЌNaCN»№“Ї÷–ЋщЇђјл„”„№ э«∞’я–°”ЏЇу’я
°Њір∞Є°њCD
°Њљвќц°њ
»хЋбµƒµзјл∆љЇв≥£ э‘љіу£ђ∆дЋб–‘‘љ«њ£ђµ»pHµƒ»хЋб»№“Ї£ђЋб–‘‘љ«њµƒЋб∆дќп÷ µƒЅњ≈®ґ»‘љ–°£ђ»хЋбЄщјл„”ЋЃљв≥ћґ»‘љ–°£ђљбЇѕ«њЋбƒ№ЇЌ»хЋб—ќЈі”¶÷∆»°»хЋбЈ÷ќцљвір°£
A£ЃЋбµƒµзјл∆љЇв≥£ э‘љіу£ђЋбµƒЋб–‘‘љ«њ£ђ«њЋбƒ№єї÷∆»°»хЋб£ђЋщ“‘ґю’яЈі”¶…ъ≥…HCNЇЌHCO3£ђјл„”Јљ≥ћ љќ™CN+H2O+CO2®THCN+HCO3£ђє A’э»Ј£ї
B£ЃЋб–‘«њ»хЋ≥–т «HCOOH>H2CO3>HCN>HCO3£ђ«њЋбƒ№ЇЌ»хЋб—ќЈі”¶…ъ≥…»хЋб£ђЋщ“‘Јі”¶Јљ≥ћ љќ™2HCOOH + CO32©Б = 2HCOO + H2O + CO2°ь£ђє B’э»Ј£ї
C£Ѓµ»pH°Ґµ»ћеїэµƒHCOOHЇЌHCN£ђn(HCN)>n(HCOOH)£ђ÷–ЇЌЋб–и“™Љоµƒќп÷ µƒЅњ”лЋбµƒќп÷ µƒЅњ°ҐЋбµƒ‘™ э≥…’э±»£ђЋщ“‘÷–ЇЌµ»ћеїэ°Ґµ»pHµƒHCOOHЇЌHCNѕыЇƒNaOHµƒЅњ«∞’я–°”ЏЇу’я£ђє Cінќу£ї
D£ЃЄщЊЁµзЇ… ЎЇг£ђc(HCOO)+c(OH)=c(Na+)+c(H+)£ђc(CN)+c(OH)=c(Na+)+c(H+)£ђЉіјл„”„№ э «n(Na+)+n(H+)µƒ2±ґ£ђґшNaCNµƒЋЃљв≥ћґ»іу£ђЉіNaCN»№“Ї÷–µƒc(OH)іу£ђc(H+)–°£ђc(Na+)ѕаЌђ£ђЋщ“‘Љ„Ћбƒ∆÷–јл„”≈®ґ»іу£ђє Dінќу£ї
є —°CD°£

 ‘ƒґЅњм≥µѕµЅ–ір∞Є
‘ƒґЅњм≥µѕµЅ–ір∞Є