题目内容
将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见表:
(1)该反应的焓变△H 0,熵变△S 0(填>、<或=).
(2)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 .
(3)若以1.12L?min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9℃),用该电池电解500mL 2mol?L-1CuSO4溶液,通电0.50min后,理论上可析出金属铜 g.
| 催化剂 |
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见表:
| 投料比 [n(H2):n(CO2)] |
500K | 600K | 700K | 800K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
(2)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式
(3)若以1.12L?min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9℃),用该电池电解500mL 2mol?L-1CuSO4溶液,通电0.50min后,理论上可析出金属铜
考点:反应热和焓变,化学电源新型电池,电解原理
专题:化学反应中的能量变化,电化学专题
分析:(1)依据平衡常数随温度变化分析判断△H;据化学方程式中反应物和生成物气体物质的量多少判断△S;
(2)甲醚作为燃料电池的原料.甲醚在负极失电子发生氧化反应,依据电极书写方法写出电极反应;
(3)甲醚燃料电池为原电池做电源电解硫酸铜溶液,锌接原电池负极做阴极,依据电解原理,阳离子移向阴极,结合电极反应电子守恒计算.
(2)甲醚作为燃料电池的原料.甲醚在负极失电子发生氧化反应,依据电极书写方法写出电极反应;
(3)甲醚燃料电池为原电池做电源电解硫酸铜溶液,锌接原电池负极做阴极,依据电解原理,阳离子移向阴极,结合电极反应电子守恒计算.
解答:
解:(1)依据图表数据分析,平衡常数随温度升高减小,平衡逆向进行,正反应为放热反应;反应物有8mol气体,生成物有4mol气体,熵减小;故答案为:<;<;
②若用甲醚作为燃料电池的原料,甲醚在负极失电子反应氧化反应,在碱性介质中电池负极的电极反应式:CH3OCH3-12e-+16OH-=2CO32-+11H2O;
故答案为:CH3OCH3-12e-+16OH-=2CO32-+11H2O;
③甲醚燃料电池设计如图所示的装置,甲醚燃料电池为原电池做电源电解硫酸铜溶液,阴极电极反应为Cu2++2e-=Cu,通入甲醚(沸点为-24.9℃)的速率为1.12L?min-1(标准状况),则通电30s后消耗甲醚的物质的量是0.56L即0.025mol,根据反应CH3OCH3-12e-+16OH-=2CO32-+11H2O,这些甲醚伴随着0.3mol电子转移,阴极电极反应为Cu2++2e-=Cu,当转移电子0.3mol时,析出金属铜的物质的量是0.15mol,质量是0.15mol×64g/mol=9.6g,
故答案为:9.6.
②若用甲醚作为燃料电池的原料,甲醚在负极失电子反应氧化反应,在碱性介质中电池负极的电极反应式:CH3OCH3-12e-+16OH-=2CO32-+11H2O;
故答案为:CH3OCH3-12e-+16OH-=2CO32-+11H2O;
③甲醚燃料电池设计如图所示的装置,甲醚燃料电池为原电池做电源电解硫酸铜溶液,阴极电极反应为Cu2++2e-=Cu,通入甲醚(沸点为-24.9℃)的速率为1.12L?min-1(标准状况),则通电30s后消耗甲醚的物质的量是0.56L即0.025mol,根据反应CH3OCH3-12e-+16OH-=2CO32-+11H2O,这些甲醚伴随着0.3mol电子转移,阴极电极反应为Cu2++2e-=Cu,当转移电子0.3mol时,析出金属铜的物质的量是0.15mol,质量是0.15mol×64g/mol=9.6g,
故答案为:9.6.
点评:本题考查了化学平衡常数的影响因素判断,原电池、电解池的电极反应书写,原理应用和电子守恒计算,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将如图所示实验装置的K闭合,下列判断正确的是( )
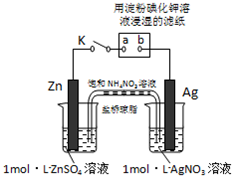

| A、Ag电极上发生氧化反应 |
| B、盐桥中NO3-向Zn电极移动 |
| C、电子沿Zn→a→b→Ag路径流动 |
| D、片刻后可观察到滤纸a点变蓝 |
下列物质中,属于氧化物的是( )
| A、H3PO4 |
| B、KOH |
| C、MgO |
| D、AgNO3 |
下列叙述正确的是( )
| A、同种元素的原子均具有相同的质子数和中子数 |
| B、不同元素的原子构成的分子只含极性键 |
| C、第三周期中的非金属元素的气态氢化物还原越强,对应元素的最高价含氧酸酸性越弱 |
| D、第ⅦA族元素从上到下单质及对应的气态氢化物的沸点均逐渐升高 |
下列实验现象的描述错误的是( )
| A、硫在氧气中剧烈燃烧,发出蓝紫色火焰 |
| B、红热的铁丝在氧气中燃烧,火星四射,生成黑色颗粒 |
| C、SO2通入石蕊试剂中,溶液先变红后褪色 |
| D、钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 |

 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.(相对原子质量 C-12 H-1 O-16)
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.(相对原子质量 C-12 H-1 O-16)