题目内容
【题目】现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,装置如图所示,其中Y为CO2。下列说法不合理的是( )
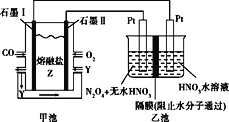
A.石墨Ⅰ是原电池的负极,发生氧化反应
B.乙池中,若使用质子交换膜,每生成1molN2O5,则有2mol H+通过交换膜进入右室
C.石墨II的电极反应式:O2+2CO2+4e-=2CO32-
D.若甲池消耗标准状况下的氧气2.24L,则乙池中产生氢气0.2mol
【答案】B
【解析】
A、CO发生氧化反应是负极,则石墨Ⅰ是原电池的负极,发生氧化反应,故A正确;
B、石墨Ⅰ是原电池的负极,则乙池中右室为阴极室,左侧为阳极室,在阳极室中发生氧化反应,方程式为N2O4-2e-+2HNO3=2N2O5+2H+,根据方程式可知每生成1molN2O5,则有1mol H+通过交换膜进入右室,故B错误;
C、石墨II为正极,氧气得电子发生还原反应,电解质为熔融碳酸钠,所以电极反应式为:O2+2CO2+4e-=2CO32-,故C正确;
D、若甲池消耗标准状况下的氧气2.24L即0.1mol,整个电路转移电子的物质的量为0.4mol,而乙池中阴极生成1mol氢气,转移2mol的电子,所以生成氢气的物质的量为0.2mol,故D正确;
故答案为B。

练习册系列答案
相关题目