题目内容
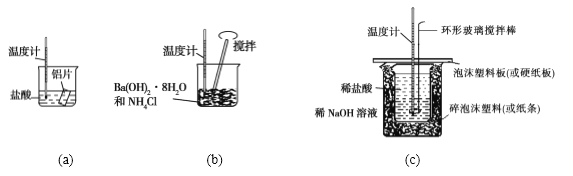
【题目】某同学设计如图所示实验,探究反应中的能量变化。
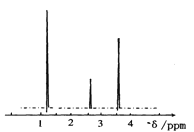
下列判断正确的是
A. 由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B. 将实验(a) 中的等质量的铝片换成铝粉后,释放出的热量有所增加
C. 实验(c)中将环形玻璃搅拌棒改为铁质搅拌棒对实验结果没有影响
D. 若用NaOH固体测定中和热,则测定结果偏高
【答案】D
【解析】
![]() 与
与![]() 反应吸热;等质量的铝片换成铝粉能量相同;铁质搅拌棒导热,致使部分热量散失;NaOH固体溶解放热。
反应吸热;等质量的铝片换成铝粉能量相同;铁质搅拌棒导热,致使部分热量散失;NaOH固体溶解放热。
A、![]() 与
与![]() 反应吸热、铝与盐酸反应放热、盐酸与氢氧化钠反应放热,故A错误;
反应吸热、铝与盐酸反应放热、盐酸与氢氧化钠反应放热,故A错误;
B、等质量的铝片换成铝粉能量相同,将实验(a) 中的等质量的铝片换成铝粉后,释放出的热量不变,故B错误;
C、中和反应反应热的测定实验中,将环形玻璃搅拌棒换成环形铁质搅拌棒,会导致部分热量散失,致使测定的最高温度偏低,反应热数值偏小,故C错误;
D、NaOH固体溶解放热,若用NaOH固体测定中和热,则测定结果偏高,故D正确,答案选D。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案【题目】某同学探究Cu与NO的反应,查阅资料:①Cu与NO反应可生成CuO和N2,②酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
(1)实验室利用Cu和稀HNO3制备NO,写出反应的化学方程式_____________。
(2)选用如图所示装置完成Cu与NO的实验。(夹持装置略) 实验开始前,向装置中通入一段时间的N2。回答下列问题:

①使用铜丝的优点是_____________________装置E的作用为_______________。
②装置C中盛放的药品可能是_________;
③装置D中的现象是_______________;装置F中反应的离子方程式是_______________。
(3)测定NaNO2和NaNO3 混合溶液中NaNO2的浓度。 取25.00mL混合溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
d.酸性KMnO4溶液中含有其他氧化性试剂
e.锥形瓶洗净后用待测液润洗
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③NaNO2 的物质的量浓度为__________