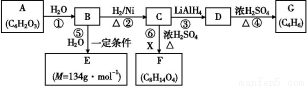
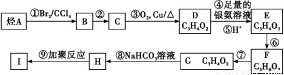
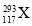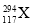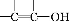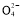题目内容
Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流等等。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是 (可以多选)
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
G.促使过饱和的硝酸钾溶液析出晶体
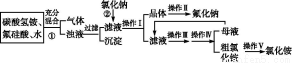
Ⅱ.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水,有刺激性气味,对人的呼吸系统有损伤,可与碱发生作用。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
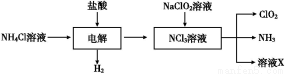
(1)写出电解时发生反应的化学方程式 ;
(2)除去ClO2中的NH3可选用的试剂是 (填序号);
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
(3)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,再加3 mL足量硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收(假设吸收完全);将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定(I2+2S2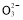
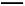 2I-+S4
2I-+S4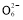 ),共用去V mL硫代硫酸钠溶液。
),共用去V mL硫代硫酸钠溶液。
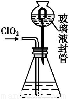
①装置中玻璃液封管的作用是 ;
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ;
③测得ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)。
Ⅰ.CE
Ⅱ.(1)NH4Cl+2HCl 3H2↑+NCl3
3H2↑+NCl3
(2)C
(3)①吸收残余的二氧化氯气体,并使锥形瓶内外压强相等
②2ClO2+10I-+8H+ 4H2O+5I2+2Cl-
4H2O+5I2+2Cl-
③1.35 cV×10-2 g
【解析】Ⅰ.A需要用玻璃棒蘸取溶液,B中需要对残留固体进行溶解、过滤、蒸发结晶,需要用玻璃棒搅拌、引流。C中用不到玻璃棒。D中配制溶液时要用玻璃棒搅拌、引流。E实验需要用铂丝,用不到玻璃棒。F用玻璃棒搅拌。G用玻璃棒摩擦烧杯壁来引发结晶。用不到玻璃棒的是C、E。
Ⅱ.(1)从流程图中可以看出电解过程中生成了H2、NCl3溶液,所以阴极上是H+得电子生成H2,阳极上是N 失去电子被氧化为NCl3,电解反应方程式:NH4Cl+2HCl
失去电子被氧化为NCl3,电解反应方程式:NH4Cl+2HCl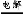 3H2↑+NCl3。(2)ClO2对人体有伤害作用,所以需用试剂吸收,又因ClO2及NH3都易溶于水,都能与碱作用,所以A、B、D不用选,只能用浓H2SO4吸收其中的NH3。
3H2↑+NCl3。(2)ClO2对人体有伤害作用,所以需用试剂吸收,又因ClO2及NH3都易溶于水,都能与碱作用,所以A、B、D不用选,只能用浓H2SO4吸收其中的NH3。
(3)①ClO2气体逸出会危害环境,玻璃密封管可以把逸出的少量气体吸收,同时通过水封与大气相通,保证锥形瓶内压强与大气压强相等。
②ClO2气体把还原性的I-氧化成I2。
③根据:I2+2S2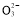
 2I-+S4
2I-+S4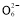 和2ClO2+10I-+8H+
和2ClO2+10I-+8H+ 4H2O+5I2+2Cl-,可以得出关系式:
4H2O+5I2+2Cl-,可以得出关系式:
2ClO2~5I2~10S2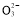 ,n(S2
,n(S2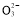 )=cV×10-3 mol,
)=cV×10-3 mol,
n(ClO2)= ,m(ClO2)=1.35 cV×10-2 g。
,m(ClO2)=1.35 cV×10-2 g。