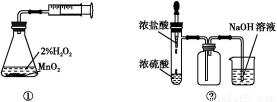
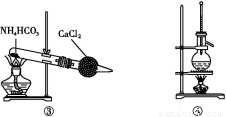
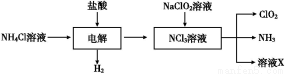
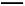题目内容
下列实验操作正确的是( )
A.测定某浓度盐酸的pH时,先将pH试纸用蒸馏水湿润
B.容量瓶用蒸馏水洗净,必须烘干后才能用于溶液的配制
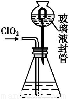
C.用苯萃取溴水中的溴之后进行分液时,水层从分液漏斗的下口放出
D.中和滴定时,锥形瓶需要用待测液润洗后才能使用
C
【解析】pH试纸测量溶液时,是不能事先润湿的,否则稀释溶液,选项A错误;容量瓶用蒸馏水洗净后,因为配制溶液过程中需加水,所以没有必要烘干,选项B错误;苯的密度小于水,实验时有机层在上层,水层在下层,水层需要从分液漏斗的下口放出,选项C正确;中和滴定时,锥形瓶不需要用待测液润洗,否则会造成待测液溶质物质的量增多,引起实验误差,选项D错误。

练习册系列答案
相关题目