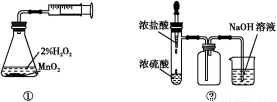
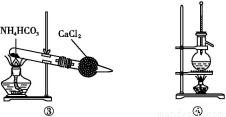
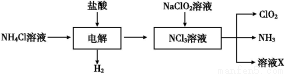
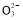题目内容
aF是一种重要的氟盐,主要用作农作物杀虫剂、木材防腐剂等。某课题组设计了以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵的实验,其工艺流程如下:
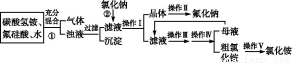
已知:20 ℃时氯化铵的溶解度为37.2 g,氟化钠的溶解度为4 g,Na2SiF6微溶于水。
(1)操作Ⅱ是洗涤、干燥,其目的是 ,
操作Ⅲ和操作Ⅳ的名称依次是 (填写序号)。
a.过滤 b.加热蒸发 c.冷却结晶 d.洗涤
(2)上述流程中①的化学反应方程式:
H2SiF6+ NH4HCO3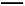 NH4F+ H2SiO3↓+ CO2↑+
NH4F+ H2SiO3↓+ CO2↑+
(3)流程①中NH4HCO3必须过量,其原因是 。
(4)若不考虑氟化钠的溶解,7.2 g氟硅酸理论上最多能生产 g氟化钠。
(1)除去氟化钠表面的氯化氨杂质 bc
(2)1 6 6 1 6 3 H2O
(3)保证H2SiF6能全部反应,防止在加入NaCl时生成Na2SiF6沉淀
(4)12.6
【解析】从整个的流程图以及最后得到的产物来看,经①生成的气体是CO2,得到的沉淀是Si元素形成的沉淀。过滤后的滤液中存在F-、N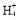 ,加入足量氯化钠后由于氟化钠的溶解度很小,而NaCl、NH4Cl溶解度都较大,所以会生成NaF沉淀;操作Ⅰ是过滤,得到NaF晶体和NH4Cl溶液,操作Ⅱ是洗涤,以除去NaF晶体表面的Cl-、N
,加入足量氯化钠后由于氟化钠的溶解度很小,而NaCl、NH4Cl溶解度都较大,所以会生成NaF沉淀;操作Ⅰ是过滤,得到NaF晶体和NH4Cl溶液,操作Ⅱ是洗涤,以除去NaF晶体表面的Cl-、N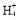 。NH4Cl溶解度较大,需要进行蒸发浓缩、冷却结晶而析出NH4Cl,然后可通过重结晶得到纯净的NH4Cl。在流程①中加入过量NH4HCO3是考虑让H2SiF6完全转化为NH4F,根据原子守恒:m(NaF)=
。NH4Cl溶解度较大,需要进行蒸发浓缩、冷却结晶而析出NH4Cl,然后可通过重结晶得到纯净的NH4Cl。在流程①中加入过量NH4HCO3是考虑让H2SiF6完全转化为NH4F,根据原子守恒:m(NaF)=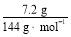 ×6×42 g· mol-1=12.6 g。
×6×42 g· mol-1=12.6 g。