��Ŀ����
����Ŀ��ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̡�
(1)��ˮ����ͨ�����ȵ�̿���ɲ���ˮú������ӦΪ��
C(s)��H2O(g)![]() CO(g)��H2(g) ��H����131.3 kJ��mol��1
CO(g)��H2(g) ��H����131.3 kJ��mol��1
��ʹ��ѧ��Ӧ���ʼӿ�Ĵ�ʩ��________(�����)��
������C�����ʵ��� �����߷�Ӧ�¶�
����ʱ����CO��H2ת��ΪCH3OH ���ܱն��������г���CO(g)
(2)����ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2 L�ĺ����ܱ������У����з�ӦCO(g)��H2O(g)CO2(g)��H2(g)���õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 2 | 4 | 0.8 | 3.2 | 3 |
��ʵ��1����v(CO2)��ʾ�Ļ�ѧ��Ӧ����Ϊ________��
�ڸ÷�Ӧ���淴ӦΪ________(������š�)�ȷ�Ӧ��
(3)��һ�ݻ�Ϊ2 L���ܱ������ڼ���2 mol��CO��6 mol��H2����һ�������·������·�Ӧ��CO(g)��2H2(g) ![]() CH3OH(g) ��H<0���÷�Ӧ���淴Ӧ������ʱ��Ĺ�ϵ��ͼ��ʾ��
CH3OH(g) ��H<0���÷�Ӧ���淴Ӧ������ʱ��Ĺ�ϵ��ͼ��ʾ��
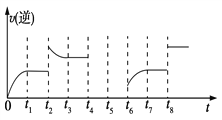
����ͼ��֪��Ӧ��t1��t3��t7ʱ���ﵽ��ƽ�⣬����t2��t8ʱ���ı������������ж�t8ʱ�ı������������________��
����t4ʱ��ѹ��t5ʱ�ﵽƽ�⣬t6ʱ����Ӧ���Ũ�ȣ�����ͼ�л���t4��t6ʱ�淴Ӧ������ʱ��Ĺ�ϵ���ߡ�________
���𰸡� �ڢ� 0.16 mol/(L��min) �� ʹ���˴��� 
��������(1)��̼�ǹ��壬����C�����ʵ�����Ӧ���ʲ��䣻�����߷�Ӧ�¶ȷ�Ӧ���ʼӿ죻����ʱ����CO��H2ת��ΪCH3OH����Ӧ��Ũ�Ƚ��ͣ���Ӧ���ʼ�С�����ܱն��������г���CO(g)����Ӧ��Ũ�ȣ���Ӧ���ʼӿ죬��ѡ�ڢܣ�
(2)��v��CO��=(4mol2.4mol)��2L/5min=0.16mol/��Lmin��������֮�ȵ��ڻ�ѧ������֮����v��CO2��=0.16mol/��Lmin������ʵ��1��CO��ת����Ϊ(42.4)/4��100%=40%��ʵ��2��CO��ת����Ϊ(43.2)/4��100%=20%����ʵ��1��ת���ʴ���ʵ��2����˵���¶�����ƽ�����淴Ӧ�����ƶ�������Ӧ���ȣ������淴Ӧ���ȣ�
(3)�ٸ���ͼ��֪��t8ʱ�淴Ӧ������������ƽ�ⲻ�ƶ������Ըı��������ʹ���˴���������t4ʱ��ѹ�����淴Ӧ���ʾ���С��ƽ�����淴Ӧ������У�t5ʱ�ﵽƽ�⣬t6ʱ����Ӧ���Ũ�ȣ��淴Ӧ����˲�䲻�䣬ƽ��������Ӧ������У�����t4��t6ʱ�淴Ӧ������ʱ��Ĺ�ϵ����Ϊ ��
��

 ��������ϵ�д�
��������ϵ�д�����Ŀ���Ҷ������е㣺197.3�棩��һ����Ҫ�ĵĻ�������ԭ�ϡ���ú���ϳ�������Ҫ�ɷ�CO��H2)���������Ʊ��õ�������������е㣺164.5�棩���ټ����Ӻϳ��Ҷ��������з�Ӧ�����º͡�������ȾС���ŵ㡣��Ӧ�������£�
��Ӧ I��4NO(g)+ 4CH3OH (g)+ O2 (g)![]() 4CH3ONO(g)+ 2H2O(g) ��H1=a kJ��mol-1
4CH3ONO(g)+ 2H2O(g) ��H1=a kJ��mol-1
��Ӧ II��2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g) ��H2=bkJ��mol-1
CH3OOCCOOCH3(l)+2NO(g) ��H2=bkJ��mol-1
��ӦIII��CH3OOCCOOCH3 (1)+ 4H2(g)![]() HOCH2CH2OH(1)+ 2CH3OH (g) ��H3=ckJ��mol-1
HOCH2CH2OH(1)+ 2CH3OH (g) ��H3=ckJ��mol-1
��1��ú���ϳ�����Ӻϳ��Ҷ��������Ȼ�ѧ����ʽ��_________���ڽϵ��������£��÷�Ӧ���Է����еĿ���ԭ����_________��
��2��CO��CH3ONO��0.4mol�ں��¡��ݻ��㶨Ϊ2L���ܱ������з�����ӦII���ﵽƽ��ʱNO���������33.3%������ʱ��������ͨ��0.4molNO��һ��ʱ������´ﵽ��ƽ��ʱNO���������_________33.3% (�>������=������<��)��
��3���¶ȸı�Է�ӦII�Ĵ���������Ӱ�죬���۴������Բ�������ʱ���ʺ�COѡ���ԣ���ʾʽ���£�
��ʱ����=![]()
CO��ѡ����=![]() ��100%
��100%
�ڲ�ͬ�¶��£�ij��ȤС�������������������ͬ�ķ�Ӧ������о���������ͬʱ��tСʱ����ÿ�ʱ���ʡ�COѡ�����������±���ʾ��
��Ӧ�¶ȣ��棩 | ��ʱ���ʣ�g�� mL-1�� h-1) | CO��ѡ���ԣ��� ) |
130 | 0.70 | �� 72.5 |
140 | 0.75 | �� 71.0 |
150 | 0.71 | �� 55.6 |
160 | 0.66 | �� 63.3 |
����˵����ȷ����_________��
A���¶����ߣ���ʱ�������������٣�˵����H2>0
B���¶����ߣ�����������������CO��ѡ�������ͣ��������ݢܿ϶�����
C��130��ʱ��CO��ѡ������ߣ�˵��CO����CH3OOCCOOCH3��ת�������
D���ۺϿ��ǿ�ʱ���ʺ�CO��ѡ���ԣ���ҵ����CH3OOCCOOCH3ʱ��ѡ��140��Ч�����
��4��120�桢��ѹʱ��CH3OOCCOOCH3+4H2![]() HOCH2CH2OH +2CH3OH ��Ӧ�����������仯��ͼ��ʾ������180�桢��ѹʱ������������÷�Ӧ�����������仯ͼ��_______
HOCH2CH2OH +2CH3OH ��Ӧ�����������仯��ͼ��ʾ������180�桢��ѹʱ������������÷�Ӧ�����������仯ͼ��_______
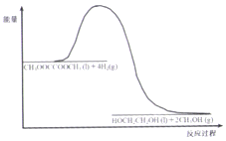
��5���о�֤ʵ���Ҷ��������������ڼ�����Һ���γ�ȼ�ϵ�أ������ĵ缫��Ӧʽ��_________��
