题目内容
某元素的原子最外电子层排布是5s25p1,该元素或其化合物不可能具有的性质是 ( )
| A.该元素单质是导体 |
| B.该元素单质在一定条件下能与盐酸反应 |
| C.该元素的最高化合价呈+5价 |
| D.该元素的氧化物的水合物显碱性 |
C
试题分析:由元素的原子最外电子层排布是5s25p1可知该元素在周期表中位于第五周期第IIIA族。是In。根据元素周期律:同一主族的元素,从上到下,随着原子核外电子层数的增多,原子半径逐渐增大,元素的金属性逐渐增强,非金属性逐渐减弱。因此该元素是金属元素,是导体。A正确。其金属性比Al强。因此该元素单质在一定条件下能与盐酸反应。B正确。由于该元素的原子的最外层有3个电子,所以最高化合价呈+3价.C错误。D.由于该元素的金属性比Al强。元素的金属性越强,其最高价氧化物对应的水化物的碱性就越强。因此该元素的氧化物的水合物显碱性。D正确。选项为C.

练习册系列答案
相关题目
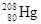 ,它的中子数为:
,它的中子数为: