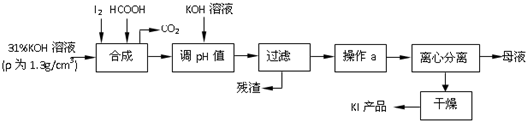
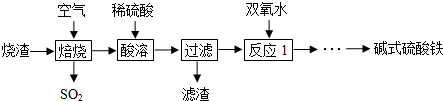
题目内容
7.采用下列装置和操作,能达到实验目的是( )
| A. | 甲装置:用所示装置分离出溴苯 | |
| B. | 乙装置:加热浓硫酸和乙醇混合液,制取乙烯 | |
| C. | 丙装置:加热苯和硝基苯的混合物,分离出苯 | |
| D. | 丁装置:验证溴乙烷发生消去反应生成烯烃 |
分析 A.互不相溶的液体采用分液方法分离;
B.浓硫酸和乙醇混合加热需要170℃,温度计测量溶液温度;
C.互溶的液体采用蒸馏方法分离,蒸馏时温度计水银球位于烧瓶支管口处;
D.乙醇也能被酸性高锰酸钾溶液氧化.
解答 解:A.互不相溶的液体采用分液方法分离,水和溴苯不互溶,所以可以采用分液方法分离,故A正确;
B.浓硫酸和乙醇混合加热需要170℃,温度计测量溶液温度,温度计应该插入混合溶液中,故B错误;
C.互溶的液体采用蒸馏方法分离,蒸馏时温度计水银球位于烧瓶支管口处,且苯易挥发,所以应该采用水浴加热,故C正确;
D.乙醇易挥发,所以生成的乙烯中含有乙醇,乙醇也能被酸性高锰酸钾溶液氧化,应该先除去乙醇,然后用酸性高锰酸钾溶液检验乙烯,故D错误;
故选AC.
点评 本题考查化学实验方案评价,为高频考点,涉及物质检验、物质的分离和提纯、物质的制备等知识点,明确实验原理是解本题关键,会从实验操作规范、实验原理等方面判断,易错选项是D.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.下列选项描述的过程能实现化学能转化为热能的是( )
| A. |  光合作用 | B. |  烧炭取暖 | C. |  风力发电 | D. |  电解冶炼 |
15.下列物质中含有非极性键的化合物是( )
| A. | NaOH | B. | Na2O2 | C. | KCl | D. | HF |
2.某元素的3p能级上有两个未成对电子,因此其( )
| A. | 第三电子层上有4个电子 | B. | 最高正价为+2 | ||
| C. | 最高正价为+4 | D. | 第二电子层没有未成对电子 |
12.下列化学用语书写正确的是( )
| A. | 氮分子的电子式 N:::N | B. | 镁原子的原子结构示意图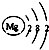 | ||
| C. | 质量数是16的氧原子 ${\;}_{8}^{16}O$ | D. | 乙醇的结构简式 C2H5OH |
19.短周期元素X、Y、Z在周期表中的位置如表所示,下列叙述不正确的是( )
| X | ||
| Y | ||
| Z |
| A. | X是活泼的非金属元素,其最高价氧化物的水化物是一种强酸 | |
| B. | Y是最活泼的非金属元素,不存在最高价氧化物的水化物 | |
| C. | Z是较活泼的非金属元素,其最高价氧化物的水化物是一种强酸 | |
| D. | X、Y、Z的单质中Z的熔点最高 |