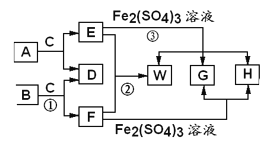
题目内容
【题目】下表是元素周期表的一部分,表中所列字母分别代表一种元素.

(1)常温下,其单质呈液态的元素是____(填字母代号),它与e形成的化合物电子式为:_____(用元素符号表示)
b元素形成的单质所属品体类型可能是____(填序号)
①分子晶体 ②原子晶体 ③金属晶体 ④离子晶体 ⑤过渡型晶体
(2)元素c、d、g的氢化物的沸点由高到低的顺序为______(用化学式表示)
【答案】m ![]() ①②⑤ H2O>HF>HCl
①②⑤ H2O>HF>HCl
【解析】
(1)常温下,呈液态的单质为溴与金属汞,由图可知位置可知,为溴单质,处于第四周期17列;
e为Na元素,溴与钠形成的化合物为NaBr,由钠离子与氯离子构成;
b为碳元素,形成的单质可能为原子晶体,如金刚石,可能为分子晶体,若富勒烯,可能为过渡型晶体,如石墨;
(2)c为氧元素、d为氟元素、g为氯元素,结合常温下氢化物状态与氢键判断氢化物的沸点。
(1)常温下,呈液态的单质为溴与金属汞,由图可知位置可知,为溴单质,处于第四周期17列,为表中m元素;
e为Na元素,溴与钠形成的化合物为NaBr,由钠离子与氯离子构成,溴化钠电子式为![]() ;
;
b为碳元素,形成的单质可能为原子晶体,如金刚石,可能为分子晶体,若富勒烯,可能为过渡型晶体,如石墨,
故答案为:①②⑤;
(2)c为氧元素、d为氟元素、g为氯元素,常温下水为液体,HF、HCl为气体,故水的沸点较高,HF中分子之间存在氢键,沸点比HCl高,故沸点H2O>HF>HCl。

【题目】研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减少温室效应具有重要的意义。工业上CO2与CH4发生反应I:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g)△H2=+41kJ/mol
(l)已知部分化学键的键能数据如下表所示:
化学键 | C—H | H—H | C=O |
|
键能(kJ/mol) | 413 | 436 | 803 | 1076 |
则△Hl =____kJ/mol,反应Ⅰ在一定条件下能够自发进行的原因是____,该反应工业生产适宜的温度和压强为____(填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO2和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。

①923K时CO2的平衡转化率大于CH4的原因是________________________
②计算923K时反应II的化学平衡常数K=______(计算结果保留小数点后两位)。
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是____。
(3)工业上CH4和CO2反应时通常会掺入O2发生反应
III: CH4+2O2=CO2+2H2O,掺人O2可消除反应产生的积碳和减小反应器的热负荷(单位时间内维持反应发生所需供给的热量),O2的进气量与反应的热负荷的关系如图所示。

①随着O2进入量的增加,热负荷下降的原因是 ____。
②掺人O2可使CH4的平衡转化率____(填“增大”、“减小”或“不变”。下同),CO2的平衡转化率________