题目内容
15.下列离子方程式正确的是( )| A. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3 NH4+ | |
| B. | 钠与水的反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 铜片跟稀硝酸的反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O | |
| D. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
分析 A.氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵;
B.离子方程式两边正电荷不相等;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.离子方程式两边负电荷不相等,不满足电荷守恒.
解答 解:A.氯化铝溶液中加入过量氨水,反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A正确;
B.钠与水的反应反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.铜片跟稀硝酸的反应生成硝酸铜、一氧化氮气体和水,正确的离子方程式为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,故C错误;
D.金属铝溶于氢氧化钠溶液,反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2H2O+2OH-═2AlO2-+3H2↑,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
5.检验溶液中是否含有Fe3+可以用的试剂是( )
| A. | 稀HCl | B. | 蔗糖溶液 | C. | KSCN 溶液 | D. | NaCl 溶液 |
3.钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染.
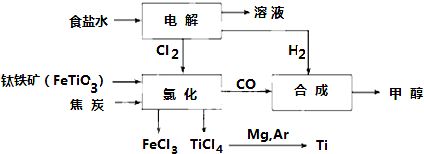
请回答下列问题:
(1)Fe位于元素周期表中第四周期第VIII族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•xH2O,再经焙烧制得.写出TiCl4水解的化学方程式:TiCl4+(2+x)H2O=TiO2.xH2O↓+4HCl.
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
(5)电解食盐水的离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.

请回答下列问题:
(1)Fe位于元素周期表中第四周期第VIII族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•xH2O,再经焙烧制得.写出TiCl4水解的化学方程式:TiCl4+(2+x)H2O=TiO2.xH2O↓+4HCl.
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
7.将相同的物质的量浓度的某弱酸HX溶液与NaX溶液人等体积混合后,测得混合后溶液中c(Na+)>c (X-),则下列关系错误的是( )
| A. | c (H+)<c (OH-) | B. | c (HX )<c (X-) | ||
| C. | c (X-)+c(HX )=2c (Na+) | D. | c (X-)-c (HX)═2(c( OH-)-c (H+)) |
4.X、Y、Z M.N是原子序数依次增大的五种短周期主族元素.其相关信息如下表所示.
(1)M位于元素周期表第四周期ⅥA族,单质M的氧化性比单质Y的氧化性弱(填“强”或“弱”)
(2)X、Z可形成化合物ZX,ZX的电子式为Na+[:H]-(用元素符号表示),ZX与盐酸反应.每生成1molX2时转移电子的物质的量为1mol
(3)实验室中检验N的简单离子的试剂是稀硝酸和硝酸银溶液,反应的离子方程式为Ag++Cl-=AgCl↓
(4)M的氢化物5.6L(标准状况下)完全燃烧生成气态氧化物后恢复到室温,放出的热量为127.6kJ,该条件下反应的热化学方程式为2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-510.4kJ/mol.
| 元素 | 相关信息 |
| X | 所有元素中原子半径最小的元素 |
| Y | 地壳中含量最多的元素 |
| Z | 短周期中原子半径最大的金属元素 |
| M | 与Y同主族 |
(2)X、Z可形成化合物ZX,ZX的电子式为Na+[:H]-(用元素符号表示),ZX与盐酸反应.每生成1molX2时转移电子的物质的量为1mol
(3)实验室中检验N的简单离子的试剂是稀硝酸和硝酸银溶液,反应的离子方程式为Ag++Cl-=AgCl↓
(4)M的氢化物5.6L(标准状况下)完全燃烧生成气态氧化物后恢复到室温,放出的热量为127.6kJ,该条件下反应的热化学方程式为2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-510.4kJ/mol.
5.环境污染已严重危害人类的生活.将对应的选项的字母填入下表中
A.氟利昂 B.SO2C.NO2D.CO2
A.氟利昂 B.SO2C.NO2D.CO2
| 环境问题 | 造成环境问题的主要物质 |
| 温室效应 | |
| 酸雨 | |
| 南极臭氧层空洞 | |
| 光化学烟雾 |