题目内容
在100mL含等物质的量的HBr和H2SO3的溶液里通入0.01mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于:
| A.0.0075mol·L-1 | B.0.008mol·L-1 | C.0.075mol·L-1 | D.0.08mol·L-1 |
D
解析试题分析: 0.01mol的cl2可提供0.02mol的电子, 1molH2SO3被氧化需2mol电子,1molHBr被氧化需1mol电子 设物质的量为x,根据题设列出方程x+0.25x=0.01 解出x=0.008 物质的量浓度则用物质的量处以体积即0.008/0.1=0.08,答案为D
考点:考查物质的量在化学方程式中应用的相关知识点。

练习册系列答案
相关题目
下列化学用语正确的是( )
A.聚丙烯的结构简式: |
B.丙烷分子的比例模型: |
C.四氯化碳分子的电子式: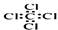 |
D.2-乙基-1,3-丁二烯分子的键线式: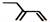 |
实验室需用2 mol·L-1氯化钠溶液450 mL,配置时应选用容量瓶的规格和称取氯化钠的质量分别是
| A.450 mL,52.7g | B.500 mL,58.5g |
| C.1000 mL,117g | D.任意规格,111.2g |
下列说法正确的是
| A.氯化钠熔化或氯化氢溶于水时都要破坏化学键 |
| B.常温常压下,18 g D2O含有6.02×1024个电子 |
| C.标准状况下,11.2LSO3所含3.01×1023个分子 |
| D.离子化合物中可能含有共价键,共价化合物中一定不含有离子键 |
某学生配制0.5mol/L的氯化钠溶液,实际浓度偏低,原因可能是
| A.天平空摆时,指针偏向标尺右边 | B.溶解后烧杯未经洗涤 |
| C.容量瓶中原有少量蒸馏水 | D.定容时腑视刻度 |
下列化学用语表达正确的是
A.乙酸分子比例模型: |
B.原于核内有18个中子的原子: Cl Cl |
C.铬原于价电子层排布图: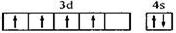 |
D.过氧化氢电子式: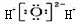 |
甲、乙两种化合物都只含x、y两种元素,甲、乙中x元素的质量分数分别为30.4%和25.9%,若已知甲的化学式是xy2,则乙的化学式只可能是
| A.xy | B.x2y | C.x2y3 | D.x2y5 |
若阿伏加德罗常数的数值用NA表示,下列说法正确的是
| A.标准状况下,1.12L氦气所含原子数为0.1NA | B.1.6gNH2- 离子所含质子数为NA |
| C.22.4 LHCl溶于水,溶液中H+数为NA | D.9g D216O所含的中子数为4.5 NA |



