题目内容
【题目】化学与社会、生产、生活密切相关.下列说法不正确的是![]()
A.医学上,血液透析是利用了胶体的渗析原理
B.碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂
C.高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强
D.铜的金属性比铝弱,可以用铜罐贮运浓硝酸
【答案】D
【解析】
![]() 血液是胶体,不能透过半透膜,代谢产生的废物是离子或小分子能透过半透膜,故A正确;
血液是胶体,不能透过半透膜,代谢产生的废物是离子或小分子能透过半透膜,故A正确;
B.碳酸氢钠分解生成碳酸钠,能够制造纯碱,碳酸氢钠能够与盐酸反应消耗盐酸,能够治疗胃酸过多,碳酸氢钠不稳定受热分解生成二氧化碳,可用作发酵,故B正确;
C.铝常温下能与空气中氧气反应,生成一层致密的氧化物保护膜,从而具有抗腐蚀性,铝合金材料的密度小,用以减轻列车质量,铝合金强度大,所以高铁车厢大部分材料采用铝合金,故C正确;
D.铜能够与浓硝酸反应而被腐蚀,所以不能用铜罐贮运浓硝酸,故D错误;
故选:D。

 考前必练系列答案
考前必练系列答案【题目】高锰酸钾是一种典型的强氧化剂,热分解产生锰酸钾、二氧化锰、氧气。完成下列填空:
I. 已知:①MnO2(s)=Mn(s)+O2(g) ΔH=+520kJ/mol
②S(s)+O2(g)=SO2(g) ΔH=-297kJ/mol
③Mn(s)+2O2(g)+S(s)=MnSO4(s) ΔH=-1065kJ/mol
(1)固体MnO2和二氧化硫气体反应生成MnSO4固体的热化学方程式为________________。
II.草酸钠滴定法测定高锰酸钾的质量分数涉及到的反应:
C2O42-+2H+→H2C2O4(草酸)
5H2C2O4+2MnO4-+6H+→2Mn2++10CO2↑+8H2O
(2)上述反应在75~80℃进行比较合适,当加热温度大于90℃时,会导致草酸钠消耗增多,其原因是______________________。
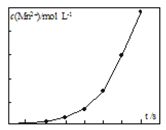
(3)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,Mn2+浓度变化由缓慢增大后迅速增大的原因是____________________________。
III .KMnO4是一种常用消毒剂。
(4)KMnO4消毒机理与下列物质相似的是__________(填序号)。
A. 双氧水 B.消毒酒精(75%) C.肥皂水 D. 84消毒液(NaClO溶液)
(5)KMnO4消毒效率(用单位质量转移的电子数表示)是NaClO的______倍(保留两位小数)。
(6)测定KMnO4产品的纯度可用标准Na2SO3溶液滴定。
①配制250ml0.1000mol/L标准Na2SO3溶液,需要使用的玻璃仪器有烧杯、胶头滴管、量筒、玻璃棒和____________。
②取某KMnO4产品0.7000g溶于水,并加入____________进行酸化。
A. 稀盐酸 B.稀硫酸 C.硝酸 D. 次氯酸
③将②所得溶液用0.1000mol/L标准Na2SO3溶液进行滴定,滴定至终点记录实验消耗Na2SO3溶液的体积。重复步骤②、③,三次平行实验数据如表:
实验次数 | 1 | 2 | 3 |
消耗Na2SO3溶液体积/ml | 19.30 | 20.98 | 21.02 |
(有关离子方程式为:2MnO4- + 5SO32- + 6H+ =5SO42- + 2Mn2+ + 3H2O)
计算该KMnO4产品的纯度为__________。(保留三位有效数字)