题目内容
以白云石(化学式表示为MgCO3·CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示。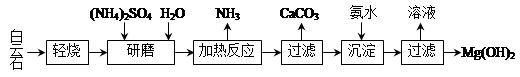
(1)研磨的作用是 。
(2)该工艺中可循环使用的物质是 、 (写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是 。
(4)加热反应的离子方程式为 。
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。
②由图可知,随着温度升高: 。
(16分)
(1)增大固体的表面积,加快反应速率,增大原料利用率(2分)
(2)NH3、(NH4)2SO4(各2分)
(3)减少能耗、减少CO2的排放等(即节能、低碳)(2分)
(4)MgO + 2NH4+ Mg2+ + 2NH3↑ + H2O(3分,写成等号不扣分)
Mg2+ + 2NH3↑ + H2O(3分,写成等号不扣分)
(5)①(3分) ②反应的时间缩短、平衡时c(NH4+)减小(合理也给分)(2分)
解析试题分析:(1)研磨的作用主要从对反应速率和原料的利用率角度分析,可以增大固体的表面积,加快反应速率,增大原料利用率;(2)图中加热反应时放出氨气,而沉淀反应时加入氨水,因此可以将氨气循环利用,图中研磨时需要加入硫酸铵和水,而过滤时得到的溶液中含有硫酸铵,因此可以将硫酸铵循环利用;(3)依题意,轻烧时只有碳酸镁分解,而碳酸钙不分解,由于二者的分解反应都是吸热反应,因此可以减少能耗、减少CO2的排放等(即节能、低碳);(4)加热反应的反应物为轻烧产生的氧化镁、研磨时加入的硫酸铵溶液,生成物是氨气,由此推断加热时溶液中发生复分解反应,根据电解质拆分原则、电荷和原子守恒原理,则该反应为MgO+2NH4+ Mg2++2NH3↑+H2O;(5)读图可知,随着温度的升高,反应速率加快,平衡向正反应方向移动,则达到平衡的时间缩短,平衡时铵根离子浓度减小,由此可以确定373K时曲线的起点、平衡点或拐点,从而可以画出曲线。
Mg2++2NH3↑+H2O;(5)读图可知,随着温度的升高,反应速率加快,平衡向正反应方向移动,则达到平衡的时间缩短,平衡时铵根离子浓度减小,由此可以确定373K时曲线的起点、平衡点或拐点,从而可以画出曲线。
考点:考查物质制备化学工艺流程,涉及研磨的作用、可以循环使用的物质、评价改进工艺的优点、关键步骤的离子方程式、温度对反应速率和平衡移动的影响规律及画出相应的图像等。

利用下列各组物质制备和收集少量相应气体,能采用如图实验装置的是
| A.浓氨水与固体CaO | B.FeS与稀硫酸 |
| C.稀硝酸与铜片 | D.电石与水 |
下列物质可用来干燥Cl2的是 ①碱石灰 ②浓硫酸 ③无水CaCl2 ④P2O5
| A.①② | B.①③④ | C.②③④ | D.①②③④ |
锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆流程之一如下: 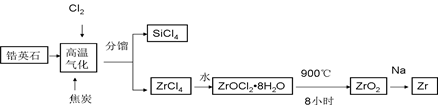
试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO): ;
(2)写出ZrOCl2?8H2O在900℃生成ZrO2的反应方程式 ;
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 (单选);
| A.二氧化锆纳米陶瓷是新型无机非金属材料 |
| B.1纳米=10-10米 |
| C.锆合金的硬度比纯锆要高 |
| D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气爆炸引起 |
如图所示是一套实验室制气装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置进行实验的是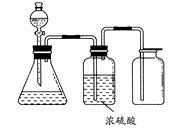
| A.铜屑和稀硝酸 |
| B.二氧化锰和浓盐酸 |
| C.用浓氨水和生石灰反应 |
| D.碳酸钙和稀盐酸 |