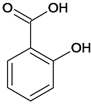
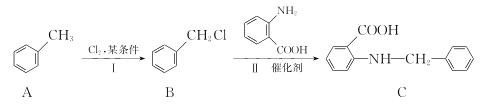
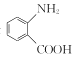
题目内容
【题目】(1)铁钉在氯气中被锈蚀为棕黄色物质![]() ,而在盐酸中生成浅绿色的
,而在盐酸中生成浅绿色的![]() 溶液。则在
溶液。则在![]() 、
、![]() 、
、![]() 中,具有氧化性的是_____________________。
中,具有氧化性的是_____________________。
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下四个反应,请写出盐酸在四个反应中,分别表现什么性质。
①![]() ________________________;
________________________;
②![]() ________________________;
________________________;
③![]() ________________________;
________________________;
④![]() ________________________。
________________________。
(3)用双线桥表示此氧化还原反应:![]() _____________________
_____________________
(4)题(2)的反应④中氧化剂与还原剂的物质的量之比为________,若有5 mol还原剂被氧化,则转移的电子数为________。
【答案】![]() 、
、![]() 酸性、氧化性 酸性 氧化性、还原性 还原性、酸性
酸性、氧化性 酸性 氧化性、还原性 还原性、酸性 
![]()
![]()
【解析】
(1)铁钉在氯气中被锈蚀为棕黄色的氯化铁,在盐酸中生成浅绿色的氯化亚铁,铁元素化合价都升高说明铁钉被氯气和氢离子氧化;
(2)①反应Zn+2HCl=ZnCl2+H2↑中,HCl中H元素的化合价降低;
②反应NaOH+HCl=NaCl+H2O中,没有元素的化合价变化;
③反应2HCl![]() H2↑+Cl2↑中,HCl中H元素的化合价降低,Cl元素的化合价升高;
H2↑+Cl2↑中,HCl中H元素的化合价降低,Cl元素的化合价升高;
④反应2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O中,HCl中部分氯元素的化合价升高,部分氯元素化合价没有变化;
(3)由化学方程式可知,反应中锰元素化合价降低被还原,KMnO4是氧化剂,HCl中氯元素的化合价升高被氧化,HCl是还原剂,反应转移的电子数目为10e—;
(4)由化学方程式可知,2mol的KMnO4被还原,有10molHCl被氧化,转移10mol电子。
(1)铁钉在氯气中被锈蚀为棕黄色的氯化铁,在盐酸中生成浅绿色的氯化亚铁,铁元素化合价都升高说明铁钉被氯气和氢离子氧化,氯气和氢离子具有氧化性,氯离子的为氯元素的最低价态,只有还原性,则氯气、氢离子和氯离子中具有氧化性的是氯气和氢离子,故答案为:Cl2、H+;
(2)①反应Zn+2HCl=ZnCl2+H2↑中,HCl中氢元素的化合价降低,体现其氧化性,反应中生成盐,还表现酸性,故答案为:氧化性、酸性;
②反应NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为中和反应,反应生成盐,HCl表现酸性;故答案为:酸性;
③反应2HCl![]() H2↑+Cl2↑中,HCl中氢元素的化合价降低,氯元素的化合价升高, HCl即表现了氧化性,也表现了还原性,故答案为:氧化性、还原性;
H2↑+Cl2↑中,HCl中氢元素的化合价降低,氯元素的化合价升高, HCl即表现了氧化性,也表现了还原性,故答案为:氧化性、还原性;
④反应2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O中,HCl中部分氯元素的化合价升高,表现了还原性,部分氯元素化合价没有变化生成盐,还表现酸性,故答案为:还原性、酸性;
(3)由化学方程式可知,反应中锰元素化合价降低被还原,KMnO4是氧化剂,HCl中氯元素的化合价升高被氧化,HCl是还原剂,反应转移的电子数目为10e—,用双线桥可表示为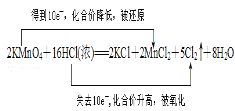 ,故答案为:
,故答案为: ;
;
(4)由化学方程式可知,2mol的KMnO4被还原,有10molHCl被氧化,则氧化剂与还原剂的物质的量之比为1:5,转移10mol电子,若有5 mol还原剂被氧化,转移5mol电子,则转移的电子数为5NA,故答案为:1:5;5NA。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )

选项 | W | X |
A | 稀硫酸 | NaAlO2溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A. A B. B C. C D. D
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是( )
A. 增大CH3OH的浓度,可使活化分子百分数增多,反应速率加快
B. 该时刻正、逆反应速率的大小:v正<v逆
C. 平衡时c(CH3OH)=0.04 mol·L-1
D. 若加入CH3OH,经10 min反应达到平衡,该时间内反应速率v(CH3OH)=1.6 mol·L-1·min-1