题目内容
现有部分短周期元素的性质或原子结构如下表:
(1)写出元素A的离子结构示意图
 .写出元素C的气态氢化物的电子式
.写出元素C的气态氢化物的电子式
 .
.
(2)元素B与氯元素相比,非金属性较强的是
a.B的单质通入氯化钠水溶液不能置换出氯气
b.氯与B形成的化合物中氯元素呈正价态
c.常温下氯气的颜色比B单质的颜色深
(3)探寻物质的性质差异性是学习的重要方法之一.A、B、C、D四种元素的单质中化学性质明显不同于其他三种单质的是
| 元素 | 元素性质或原子结构 |
| A | 最外层电子数是次外层电子数的3倍 |
| B | 该元素是所有元素中非金属性最强的 |
| C | L层只有5个电子 |
| D | 第3周期元素的简单离子中半径最小 |




(2)元素B与氯元素相比,非金属性较强的是
F
F
(用元素符号表示),下列表述中能证明这一事实的是b
b
.a.B的单质通入氯化钠水溶液不能置换出氯气
b.氯与B形成的化合物中氯元素呈正价态
c.常温下氯气的颜色比B单质的颜色深
(3)探寻物质的性质差异性是学习的重要方法之一.A、B、C、D四种元素的单质中化学性质明显不同于其他三种单质的是
Al
Al
(填元素符号),理由是具有金属性
具有金属性
.分析:短周期元素,由最外层电子数是次外层电子数的3倍,则A有2个电子层,最外层电子数为6,即A为O;所有元素中非金属性最强的元素是F,则B为F;C的L层只有5个电子,则C为N;第3周期元素的简单离子中半径最小的为铝离子,则D为Al,然后利用元素及其单质、化合物的性质来解答.
解答:解:短周期元素,由最外层电子数是次外层电子数的3倍,则A有2个电子层,最外层电子数为6,即A为O;所有元素中非金属性最强的元素是F,则B为F;C的L层只有5个电子,则C为N;第3周期元素的简单离子中半径最小的为铝离子,则D为Al,
(1)A为O,质子数为8,得到2个电子变为离子,离子结构示意图为 ,C为N,其其它氢化物为氨气,电子式为
,C为N,其其它氢化物为氨气,电子式为 ,
,
故答案为: ;
; ;
;
(2)所有元素中非金属性最强的元素是F,非金属性F>Cl,氟单质和溶液中的水反应,则不能置换出Cl,不能利用单质的颜色来比较非金属性,但在化合物中F显负价,则非金属性强,故答案为:F;b;
(3)A、B、C、D四种元素中只有Al为金属,具有金属性,故答案为:Al;具有金属性.
(1)A为O,质子数为8,得到2个电子变为离子,离子结构示意图为
 ,C为N,其其它氢化物为氨气,电子式为
,C为N,其其它氢化物为氨气,电子式为 ,
,故答案为:
 ;
; ;
;(2)所有元素中非金属性最强的元素是F,非金属性F>Cl,氟单质和溶液中的水反应,则不能置换出Cl,不能利用单质的颜色来比较非金属性,但在化合物中F显负价,则非金属性强,故答案为:F;b;
(3)A、B、C、D四种元素中只有Al为金属,具有金属性,故答案为:Al;具有金属性.
点评:本题考查位置、结构、性质的应用,元素的推断是解答本题的关键,D是学生解答的难点,注意离子半径比较的方法“径小序大”来分析解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目


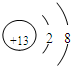




 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-