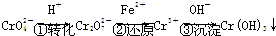题目内容
水是生命之源,2005年12月发生在我省的北江水污染事件再次提醒人们保护水资源的必要性和紧迫性.(1)据报道,北江水污染事件是由于某冶炼厂设备检修期间排放的废水所致,推测其主要污染物是______.如果有害废水已经在河流中扩散,为了尽量减少危害,对河水的处理应该采取的措施是______
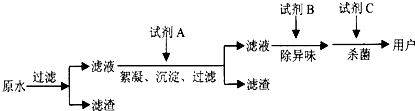
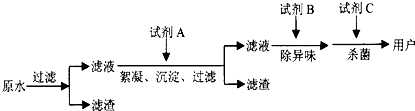
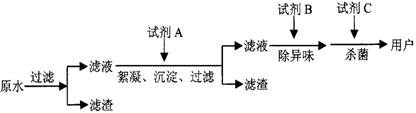
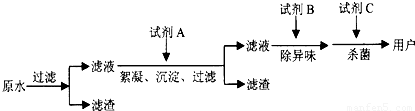
(2)自来水的生产流程如图,其中的试剂A、B、C分别可以选择______、______、______.
(3)电镀厂排放的废水中含铬(以Cr2O72-形式存在),常用电解的方法处理.电解时,以铁为阳极,生成的Fe2+将Cr2O72-还原为Cr3+,产物再与电解时生成的OH-形成氢氧化物沉淀而除去.
①两个电极上发生的反应分别为:阳极______,阴极______.
②溶液中发生的总反应为(用离子方程式表示)______.
(4)化学需氧量(COD)是水体质量的控制项目这一,它是量废水中还原性污染物的重要指标.COD是指用强氧化剂(我国采用K2Cr2O7)处理一定量水样时消耗的氧化剂的量,并换算成以O2作为氧化剂时,1L水样所消耗O2的质量.现取某池塘水样20.00mL,反应消耗10.00mL0.0400mol?L-1K2Cr2O7溶液(反应后转化为Cr3+).该水样的COD为______mg?L-1.
【答案】分析:(1)根据是冶炼厂的污水造成的污染,一般是重金属离子造成的,可以采用稀释方法处理;
(2)根据加入试剂的目的选择合理的试剂,如杀菌使用强氧化性的试剂;
(3)①阳极发生氧化反应,阴极发生还原反应;
②溶液中亚铁离子被重铬酸钾氧化成铁离子,溶液中有氢氧根离子,生成了氢氧化铁和氢氧化铬沉淀;
(4)根据电子守恒计算.
解答:解:(1)由于是冶炼厂的污水污染,应该是重金属离子引起的,可以利用上游没有污染的水进行稀释,降低重金属离子浓度,
故答案为:重金属离子;利用上游水源稀释;
(2)加入试剂A加快水中不溶性固体小颗粒的沉降,可以选择明矾或者硫酸铁,
试剂B除去水的异味,可以选择活性炭,
试剂C起到杀菌的作用,通常选用氯气或者ClO2、O3等,
故答案为:明矾(或硫酸铁等); 活性炭; Cl2(或ClO2、O3等);
(3)①阳极铁失去电子,电极反应是:Fe-2e-=Fe2+,阴极水电离的氢离子得到电子,电极反应为:2H++2e-=H2↑,
故答案为:Fe-2e-=Fe2+;2H++2e-=H2↑;
②溶液中发生的反应是,亚铁离子被重铬酸钾离子氧化成铁离子,重铬酸钾被还原成铬离子,铁离子和铬离子结合溶液中的氢氧根离子算错了氢氧化铁和氢氧化铬沉淀,反应的总离子反应方程式是:6Fe2++Cr2O72-+10 OH-+7H2O=6Fe(OH)3↓+2Cr(OH)3↓,
故答案为:6Fe2++Cr2O72-+10 OH-+7H2O=6Fe(OH)3↓+2Cr(OH)3↓;
(4)10.00mL0.0400mol?L-1K2Cr2O7溶液完全反应转移电子物质的量是:0.01L×0.0400mol/L×2(6-3)=2.4×10-3mol,需要消耗氧气的物质的量是: ×2.4×10-3mol=6×10-4mol,1L水样消耗的氧气是质量是:
×2.4×10-3mol=6×10-4mol,1L水样消耗的氧气是质量是: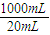 ×6×10-4mol×32g/mol=0.96g=960mg,
×6×10-4mol×32g/mol=0.96g=960mg,
故答案为:960.
点评:本题考查了水样含氧测定,涉及了污水处理、电解反应方程式书写等知识,本题难度中等.
(2)根据加入试剂的目的选择合理的试剂,如杀菌使用强氧化性的试剂;
(3)①阳极发生氧化反应,阴极发生还原反应;
②溶液中亚铁离子被重铬酸钾氧化成铁离子,溶液中有氢氧根离子,生成了氢氧化铁和氢氧化铬沉淀;
(4)根据电子守恒计算.
解答:解:(1)由于是冶炼厂的污水污染,应该是重金属离子引起的,可以利用上游没有污染的水进行稀释,降低重金属离子浓度,
故答案为:重金属离子;利用上游水源稀释;
(2)加入试剂A加快水中不溶性固体小颗粒的沉降,可以选择明矾或者硫酸铁,
试剂B除去水的异味,可以选择活性炭,
试剂C起到杀菌的作用,通常选用氯气或者ClO2、O3等,
故答案为:明矾(或硫酸铁等); 活性炭; Cl2(或ClO2、O3等);
(3)①阳极铁失去电子,电极反应是:Fe-2e-=Fe2+,阴极水电离的氢离子得到电子,电极反应为:2H++2e-=H2↑,
故答案为:Fe-2e-=Fe2+;2H++2e-=H2↑;
②溶液中发生的反应是,亚铁离子被重铬酸钾离子氧化成铁离子,重铬酸钾被还原成铬离子,铁离子和铬离子结合溶液中的氢氧根离子算错了氢氧化铁和氢氧化铬沉淀,反应的总离子反应方程式是:6Fe2++Cr2O72-+10 OH-+7H2O=6Fe(OH)3↓+2Cr(OH)3↓,
故答案为:6Fe2++Cr2O72-+10 OH-+7H2O=6Fe(OH)3↓+2Cr(OH)3↓;
(4)10.00mL0.0400mol?L-1K2Cr2O7溶液完全反应转移电子物质的量是:0.01L×0.0400mol/L×2(6-3)=2.4×10-3mol,需要消耗氧气的物质的量是:
 ×2.4×10-3mol=6×10-4mol,1L水样消耗的氧气是质量是:
×2.4×10-3mol=6×10-4mol,1L水样消耗的氧气是质量是: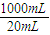 ×6×10-4mol×32g/mol=0.96g=960mg,
×6×10-4mol×32g/mol=0.96g=960mg,故答案为:960.
点评:本题考查了水样含氧测定,涉及了污水处理、电解反应方程式书写等知识,本题难度中等.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目