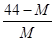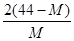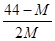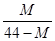题目内容
一定温度下,l mol X和n mol Y在体积为2L的密闭容器中发生如下反应:X(g)+Y(g) 2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
 2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是| A.用X表示此反应的反应速率是(0.1—0.2a)mol·(L·min)-1 |
| B.当混合气体的质量不再发生变化时,说明反应达到平衡状态 |
| C.向平衡后的体系中加入l mol M,平衡向逆反应方向移动 |
| D.向上述平衡体系中再充入l mol X,v(正)增大,v(逆)减小,平衡正向移动 |
B
化学反应速率的计算,从Z单位时间的物质的量浓度变化求出v(Z)="(2a" mol/2L)/5min ="0.2amol/(L.min)" ,再根据化学反应速率之比=化学计量数之比,即v(Z)="2v(X)" ,v(X)=1/2v(Z)=0.1amol/(L.min),故A错;
因反应前后气体的总质量不相等(质量守恒定律),即m(X)+m(Y)>m(Z),若正反应速率大于逆反应速率,气体的质量是持续减少的,若正反应速率小于逆反应速率,气体的质量是持续增大的,故混合气体质量不变之时,就是化学反应达到平衡状态之时,B正确;
向平衡后的体系中加入1mol固态M,对气态体系的平衡的影响看作不变,故C错;
向上述平衡体系中再充入1mol气态X,导致整个体系的压强增大,v(正)与v(逆)同样增大,只是v(正)瞬间增大的倍数比v(逆)的要大得多,故平衡向正反应方向移动。D错
因反应前后气体的总质量不相等(质量守恒定律),即m(X)+m(Y)>m(Z),若正反应速率大于逆反应速率,气体的质量是持续减少的,若正反应速率小于逆反应速率,气体的质量是持续增大的,故混合气体质量不变之时,就是化学反应达到平衡状态之时,B正确;
向平衡后的体系中加入1mol固态M,对气态体系的平衡的影响看作不变,故C错;
向上述平衡体系中再充入1mol气态X,导致整个体系的压强增大,v(正)与v(逆)同样增大,只是v(正)瞬间增大的倍数比v(逆)的要大得多,故平衡向正反应方向移动。D错

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
 2Z(g),此反应达到平衡的标志是( )
2Z(g),此反应达到平衡的标志是( )  Y(g)+W(g)的进行情况。其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol·L-1,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是( )
Y(g)+W(g)的进行情况。其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol·L-1,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是( )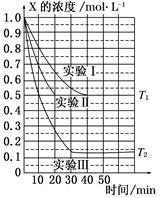
 2HI(g) DH<0。下列说法正确的是
2HI(g) DH<0。下列说法正确的是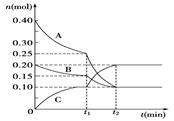
 B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示: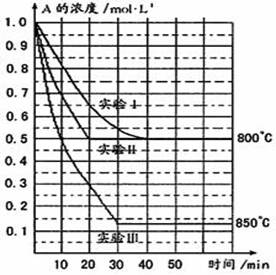
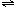 2C(气)达到平衡的标志是
2C(气)达到平衡的标志是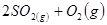

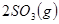 ,△H
,△H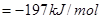 ,在相同温度下,向固定体积的密闭容器中通入
,在相同温度下,向固定体积的密闭容器中通入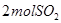 和
和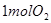 ,达到平衡时放出热量
,达到平衡时放出热量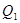 ;向另一个同体积的密闭容器中通入
;向另一个同体积的密闭容器中通入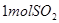 和
和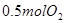 ,达到平衡时放出热量为
,达到平衡时放出热量为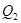 ,则下列关系中正确的是
,则下列关系中正确的是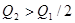
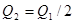
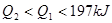

 2CO+O2(反应从CO2开始)平衡体系的平均相对分子质量为M,在此条件下,CO2的分解率为
2CO+O2(反应从CO2开始)平衡体系的平均相对分子质量为M,在此条件下,CO2的分解率为