题目内容
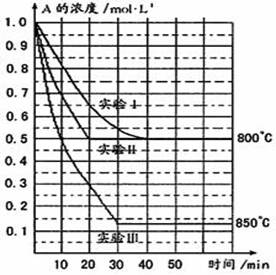
(8分)在一恒容密闭容器中发生某化学反应2A(g)  B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
试回答下列问题:
(1)在实验Ⅰ中,反应在20 min至40 min内A的平均反应速率为____ ______。
(2)实验Ⅱ和实验I相比,可能隐含的反应条件是_______________ ______________。
(3)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应降低温度,平衡向_____(填“正”或“逆”)反应方向移动,该正反应是_________(填“放热”或“吸热”)反应。
(4)与实验Ⅰ相比,若实验Ⅰ中的A的起始浓度改为0.8 mol·L-1,其它条件不变,则达到平衡时所需用的时间___________实验Ⅰ(填写“大于”、“等于”或“小于”)。
 B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
试回答下列问题:
(1)在实验Ⅰ中,反应在20 min至40 min内A的平均反应速率为____ ______。
(2)实验Ⅱ和实验I相比,可能隐含的反应条件是_______________ ______________。
(3)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应降低温度,平衡向_____(填“正”或“逆”)反应方向移动,该正反应是_________(填“放热”或“吸热”)反应。
(4)与实验Ⅰ相比,若实验Ⅰ中的A的起始浓度改为0.8 mol·L-1,其它条件不变,则达到平衡时所需用的时间___________实验Ⅰ(填写“大于”、“等于”或“小于”)。
(共8分) (1)0.0075(7.5×10-3) mol·L-1·min-1 (2分) ; (2)实验Ⅱ使用了催化剂 (2分) ;
(3)逆 (1分);吸热 (1分) ; (4)大于 (2分)
(3)逆 (1分);吸热 (1分) ; (4)大于 (2分)
(1)由图像可知实验Ⅰ时,在20 min时A的浓度为0.65 mol·L-1,40 min时A的浓度为0.50 mol·L-1所以反应速率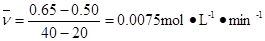
(2)相同温度下由图可知实验Ⅱ和实验I在平衡时A的浓度相同,说明二者的平衡相同,但是实验Ⅱ比试验I达到平衡所需要的时间较短,实验Ⅱ反应速率较快,平衡不变,只是加快了反应速率则实验Ⅱ可能使用了催化剂。
(3)分析实验Ⅲ和实验Ⅰ的平衡状态并联系温度可以得出温度越高平衡时A的浓度越低,说明温度越高平衡向消耗A的方向进行(即正反应方向),可得到温度越高,平衡向正反应方向进行,反之,降低温度平衡向逆反应方向进行,又升高温度向吸热方向进行,则可得出正反应方向即为吸热反应方向。
(3)若实验Ⅰ中的A的起始浓度改为0.8 mol·L-1,其它条件不变,由于反应物的浓度降低所以反应速率减小,达到平衡的时间会延长,所用的时间会大于实验Ⅰ。
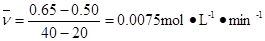
(2)相同温度下由图可知实验Ⅱ和实验I在平衡时A的浓度相同,说明二者的平衡相同,但是实验Ⅱ比试验I达到平衡所需要的时间较短,实验Ⅱ反应速率较快,平衡不变,只是加快了反应速率则实验Ⅱ可能使用了催化剂。
(3)分析实验Ⅲ和实验Ⅰ的平衡状态并联系温度可以得出温度越高平衡时A的浓度越低,说明温度越高平衡向消耗A的方向进行(即正反应方向),可得到温度越高,平衡向正反应方向进行,反之,降低温度平衡向逆反应方向进行,又升高温度向吸热方向进行,则可得出正反应方向即为吸热反应方向。
(3)若实验Ⅰ中的A的起始浓度改为0.8 mol·L-1,其它条件不变,由于反应物的浓度降低所以反应速率减小,达到平衡的时间会延长,所用的时间会大于实验Ⅰ。

练习册系列答案
相关题目
 CO(g)+H2O(g),
CO(g)+H2O(g), 2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是 2HI(g);△H<0,有相同容积的密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入0.1mol H2和0.2molI2,相同温度下分别达到平衡。下列说法不正确的是
2HI(g);△H<0,有相同容积的密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入0.1mol H2和0.2molI2,相同温度下分别达到平衡。下列说法不正确的是 2AB(g)达到平衡状态的标志是
2AB(g)达到平衡状态的标志是 CH3OH(g) ΔH
CH3OH(g) ΔH
 cZ(g);?H<0(放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是:
cZ(g);?H<0(放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是:
 PCl3(气) +Cl2(气) △H>0 当反应达到平衡时,下列措施:①降温②恒容通入惰性气体③增加Cl2的浓度④加压⑤加催化剂⑥恒压通入惰性气体,能提高PCl5质量分数的是
PCl3(气) +Cl2(气) △H>0 当反应达到平衡时,下列措施:①降温②恒容通入惰性气体③增加Cl2的浓度④加压⑤加催化剂⑥恒压通入惰性气体,能提高PCl5质量分数的是