题目内容
【题目】现有下列十种物质:①HCl;②NaHCO3;③K2SO4溶液;④SiO2;⑤蔗糖晶体;⑥NaOH;⑦氢氧化铁胶体;⑧NH3·H2O;⑨空气;⑩Al2(SO4)3
(1)上述物质中属于电解质的有____(填序号),向⑦中逐滴滴入过量的①的水溶液,出现的实验现象是___。
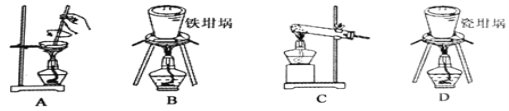
(2)用④与⑥焙烧制备硅酸钠,可采用图中的装置为____(填选项编号)。
【答案】①②⑥⑧⑩ 先出现红褐色沉淀后沉淀溶解,溶液呈黄色 B
【解析】
(1)电解质,在水溶液中或熔融状态下能够导电的化合物,包括了酸、碱、盐、金属氧化物、水;
①HCl,酸,溶于水能电离出H+和Cl-可以导电,是电解质;
②NaHCO3,盐,在水溶液中能够电离出Na+和HCO3-,能导电,是电解质;
③K2SO4溶液,是混合物,不是化合物,不是电解质;
④SiO2,不溶于水,在熔融状态下,不电离,不是电解质;
⑤蔗糖,不管是在水溶液中,还是熔融状态下,均不电离出离子,不导电,不是电解质;
⑥NaOH,碱,溶于水能电离出OH-和Na+,可以导电,是电解质;
⑦氢氧化铁胶体,是混合物,不是化合物,不是电解质;
⑧NH3·H2O,在水溶液中,能够电离出NH4+和OH-,是电解质;
⑨空气,是混合物,不是化合物,不是电解质;
⑩Al2(SO4)3,在水溶液中,能够电离出Al3+和SO42-,可以导电,是电解质;
是电解质的为①②⑥⑧⑩;
胶体遇到电解质溶液首先会发生聚成,然后Fe(OH)3与HCl反应生成FeCl3,现象为先出现红褐色沉淀后沉淀溶解,溶液呈黄色;
(2)用SiO2与NaOH焙烧制备硅酸钠,煅烧固体选择坩埚,因此排除A和C,由于瓷坩埚的成分中含有二氧化硅,会与碱性物质反应,会被NaOH腐蚀,以免腐蚀瓷坩埚。因此不能选用瓷坩埚,而是铁坩埚,答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
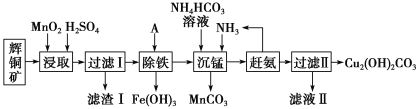
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
② Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有__________(任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:______________。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_________,若加 A 后溶液的 pH调为4.0,则溶液中 Fe3+的浓度为_________mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:_________________________。
(5)“赶氨”时,最适宜的操作方法是________________。
(6)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是________________。
【题目】现有部分元素的性质与原子(或分子)结构如表所示:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:______。
(2)元素Y与元素Z相比,金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______(填字母)。
A.Y单质的熔点比Z单质低
B.Y的化合价比Z低
C.Y单质与水反应比Z单质与水反应剧烈
D.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:______。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)______r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式______________________。