题目内容
【题目】将一枚洁净的铁钉浸入稀硫酸中,下列叙述正确的是( )
①铁钉表面产生气泡 ②溶液由无色逐渐变为浅绿色 ③铁钉的质量减轻 ④溶液的质量减轻
A.②③B.①②④C.①②③D.①②③④
【答案】C
【解析】
将一枚洁净的铁钉浸入稀硫酸中,Fe属于活泼金属,能和稀H2SO4反应生成FeSO4和H2气体,所以①铁钉表面产生气泡正确;因为FeSO4溶液为浅绿色,所以②溶液由无色逐渐变为浅绿色正确,③铁钉溶解质量减轻,故③正确;溶液的质量增重,故④错误;所以C符合题意;
答案:C。

【题目】B、N、F、Ti、Fe等都是重要的材料元素,其单质及化合物在诸多领域都有广泛的应用。
(1)在基态Ti原子中,核外存在________对自旋相反的电子,核外电子中占据的最高能层符号为___,占据该能层电子的电子云轮廓图形状为_________ 。
(2)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,五氮阴离子N5-是制备全氮类物质N5+N5-的重要中间体,下列说法不正确的是_________。
A. (N5)6(H3O)3(NH4)4Cl中含四种离子 B. N5+N5-属于共价化合物
C.每个N5-中含有36个电子 D. N5+N5-中既含极性键又含非极性键
(3)NH3分子空间结构为_______;在BF3中B原子的杂化方式为______。
(4)六氟合钛酸钾(K2TiF6)中存在[TiF6]2-离子,则钛元素的化合价是______,配体是_____。
(5)碳酸盐的热分解是由于晶体中阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果。已知
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
请解释碱土金属元素碳酸盐热分解温度的变化规律:____________。
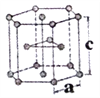
(6)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.295nm,c=0.469nm,则该钛晶体的密度为______g/cm3(用NA表示阿伏伽德罗常数的值,列出计算式即可)。
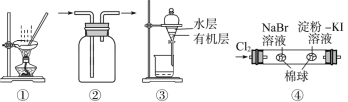
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
A | 有三个电子层,K、M层电子数之和等于L层电子数 |
B | 短周期中金属性最强 |
C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
D | 元素最高正价是+7价 |
回答下列问题:
(1)A元素在周期表中的位置_______________;
(2)B元素原子结构示意图_______________;
(3)A、B、D按原子半径从大到小排序依次为_______________(用元素符号表示);
(4)元素D与元素A相比,非金属性较强的是_______________(用元素符号表示),下列表述中不能证明这一事实的是_______________(填选项序号)。
a 一定条件下D和A的单质都能与钠反应
b D的氢化物比A的氢化物稳定
c D单质能与A的氢化物反应生成A单质
d A的最高价含氧酸酸性弱于D的最高价含氧酸