题目内容
(9分)某中学化学兴趣小组在课外活动时,对学校附近的甲、乙两条河流的水质进行了多次检测。第一组检测甲河流的水质结果如下:
(1)三次检测结果中第 次的结果肯定不正确。
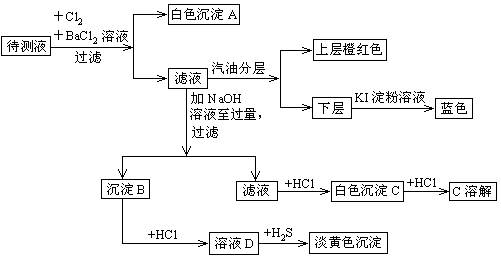
(2)在检测时,为了确定溶液中是否存在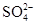 、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。
、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。
(3)第二组对乙河流进行检测,乙河流两边有甲、乙两工厂,经检测它们排放的工业废水中共含有K+、Ag+、Fe3+、、Cl–、OH–、 六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为 、 、 。
六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为 、 、 。
| 检测次数 | 溶液中检测出的溶质 |
| 第一次 | KCl K2SO4 Na2CO3 NaCl |
| 第二次 | KCl BaCl2 Na2SO4 K2CO3 |
| 第三次 | Na2SO4 KCl K2CO3 NaCl |
(2)在检测时,为了确定溶液中是否存在
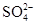 、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。
、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。
(3)第二组对乙河流进行检测,乙河流两边有甲、乙两工厂,经检测它们排放的工业废水中共含有K+、Ag+、Fe3+、、Cl–、OH–、
 六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为 、 、 。
六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为 、 、 。(1)二(2)①CO32– 2H++CO32-="=" H2O + CO2 ↑ ② Ba(NO3)2 ③AgNO3 Ag+
(3)OH- K+ Cl-
(3)OH- K+ Cl-
试题分析:(1)由于Ba2+和SO42-不共存,所以二组一定是错误的。(2)向溶液中滴加过量的HNO3溶液,检验CO32-离子是否存在,反应的离子方程式为:2H++CO32-="=" H2O + CO2↑,检验SO42-离子的存在要加Ba(NO3)2,检验Cl-的存在要加入AgNO3。(3)因为甲厂的废水明显呈碱性,所以有OH-存在,不能与OH-共存的离子有Ag+、Fe3+,而与Ag+、Fe3+共存的离子有NO3-,这三种离子应该在乙厂废水中含有,所以甲厂排放的离子有OH- K+ Cl-。
点评:离子不能大量共存的一般情况是:(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质);(2)能生成难溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-);(3)能完全水解的离子之间,如多元弱酸和弱碱盐的阴、阳离子(如:Al3+, Fe3+与 CO32-、HCO3-、AlO2-、ClO-,S2-等);(4)能发生氧化还原反应的离子之间(如:Fe 、H+、NO3-;S2-、ClO-;S2-、 Fe3+等);(5)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。

练习册系列答案
相关题目