题目内容
(8分)某澄清透明溶液中,可能含有NH4+、Mg2+、Al3+、Fe2+、Br—、SO42—、NO3—、CO32—等离子的一种或几种,进行下列实验:
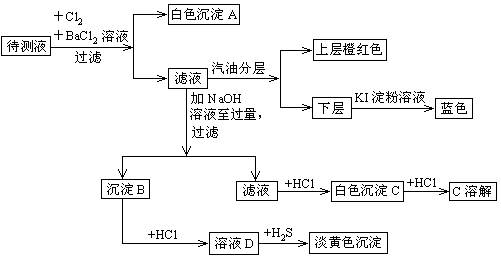
根据实验结果回答:
⑴溶液中肯定有的离子是___________。
⑵判断待测溶液中有无CO32—,并说明理由________________________________。
⑶沉淀B肯定有什么物质___________,生成淡黄色沉淀的离子方程式 ___________。

根据实验结果回答:
⑴溶液中肯定有的离子是___________。
⑵判断待测溶液中有无CO32—,并说明理由________________________________。
⑶沉淀B肯定有什么物质___________,生成淡黄色沉淀的离子方程式 ___________。
(8分)⑴Br-、Al3+、Fe2+、SO42- ⑵无,与Al3+发生双水解反应不能大量共存
⑶Fe(OH)3 2Fe3++H2S=2Fe2++S↓+H+
⑶Fe(OH)3 2Fe3++H2S=2Fe2++S↓+H+
待测液加入氯气和氯化钡,生成白色沉淀,则该沉淀是硫酸钡,所以一定含有SO42- 。滤液萃取,上层呈橙红色,石墨有单质溴生成,所以一定含有溴离子。下层加入碘化钾溶液,溴蓝色,说明有单质碘生成,因此滤液中含有能氧化碘离子的氧化剂。滤液加入过量的氢氧化钠溶液,生成沉淀,沉淀能溶解在盐酸中,而生成的D能和硫化氢反应生成淡黄色沉淀,沉淀是硫,因为铁离子能氧化硫化氢生成单质S沉淀。所以D中含有的应该是铁离子,即沉淀B是氢氧化铁,所以原溶液中一定含有亚铁离子。根据转化可知,白色沉淀C是氢氧化铝,所以一定含有铝离子。由于CO32—与Al3+发生双水解反应不能大量共存,所以一定没有CO32—。

练习册系列答案
相关题目
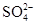 、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。
、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。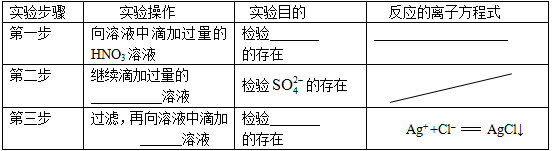
 六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为 、 、 。
六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为 、 、 。