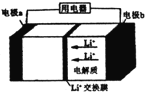
题目内容
【题目】常温下S2Cl2是橙黄色液体,其分子结构如图所示.少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液.下列关于S2Cl2的说法错误的是( ) 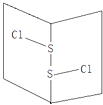
A.为非极性分子
B.分子中既含有极性键又含有非极性键
C.与S2Br2结构相似,熔沸点S2Br2>S2Cl2
D.与水反应的化学方程式可能为2S2Cl2+2H2O→SO2↑+3S↓+4HCl
【答案】A
【解析】解:A、该分子中,电荷的分布是不均匀的,不对称的,所以是极性分子,故A错误.
B、Cl﹣S﹣S﹣Cl 中硫原子和硫原子之间存在非极性键,硫原子和氯原子之间存在极性键,故B正确.
C、S2Br2与S2Cl2均属于分子晶体,分子晶体中,分子量越大则熔沸点越高,所以熔沸点:S2Br2>S2Cl2,故C正确.
D、Cl﹣S﹣S﹣Cl 遇水易水解,并产生酸性悬浊液,说明有不溶于水的物质生成,且有溶于水呈酸性的物质生成,根据反应前后元素守恒知,生成不溶于水的物质是S单质,同时生成二氧化硫和氯化氢,所以水解方程式为2S2Cl2+2H2O→SO2↑+3S↓+4HCl,故D正确.
故选:A.
A、分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,是不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子.
B、同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键.
C、分子晶体中,分子量越大则熔沸点越高;
D、遇水易水解,并产生酸性悬浊液,说明有沉淀生成、有酸性物质生成.

【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
I.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-53.7kJ·mol-1
CH3OH(g)+H2O(g) △H1=-53.7kJ·mol-1
I.CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.l | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.l | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]XCat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比。
已知:①CO和H2的标准燃烧热分别为-283.0kJ/mol和一285.8kJ/mol;
②H2O(l)==H2O(g) △H3=+44.0kJ·mol-1
请回答下列问题(不考虑温度对△H的影响):
(1)反应I在_________(填“低温”或“高温”)下自发进行;反应II每生成9g水蒸气放出热量为___________。
(2)恒容条件下,有利于提高CO2转化为CH3OH的平衡转化率的措施有_____(填字母代号)。
A.延长反应时间 B.使用催化剂Cat.2 C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
(3)由表中实验数据可以得出的结论是_______________________。
(4)553K,使用催化剂Cat.2,在该时刻H2的转化率为______(填字母代号)。
A.5.5% B.13.3% C.16.4% D.29.3%
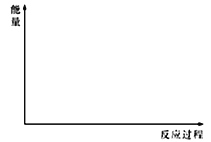
(5)在下图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图。________
(6)研究证实,CO2也可在硫酸溶液中用情性电解生成甲醇,则生成甲醇的电极反应式是_________,另一极的电解产物为______________________。
【题目】表是25℃时四种酸的电离平衡常数:
化学式 | CH3COOH | HA | HNO2 | H2CO3 |
Ka | Ka=1.8×10﹣5 | Ka=4.9×10﹣10 | Ka=4.6×10﹣4 | Ka1 =4.1×10﹣7 |
(1)用离子方程式表示NaNO2溶液呈碱性的原因
(2)25℃时,向向0.1molL﹣1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO﹣)=5:9,此时溶液pH=
(3)写出NaA溶液中通少量CO2的离子方程式
(4)25℃时,等物质的量浓度的HA、NaA混合溶液呈碱性,溶液中各离子浓度的大小顺序为
(5)已知HNO2不稳定,在稀溶液中也易分解生成NO与NO2 , 某同学分别取少量NaCl溶液与NaNO2溶液于试管中,分别滴加浓醋酸,以此来鉴别失去标签的NaCl溶液和NaNO2溶液,该方法(填“可行”或“不可行”),理由是
(6)已知NaHCO3溶液中存在HCO3H++CO32﹣ , 加水稀释时溶液中的c(H+)将(填“增大”或“减小”)
【题目】常温下氨气能被氯气氧化成N2,化工厂常用浓氨水检验管道是否泄漏氯气。某兴趣小组在实验室对氨气与氯气反应进行了探究,回答下列问题:
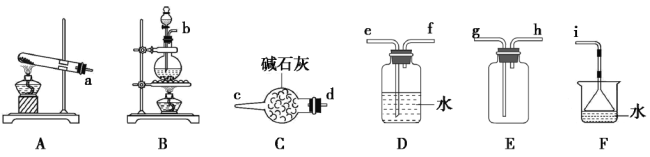
(1)氯气的发生装置可以选择上图中的_________(填大写字母),反应的离子方程式为________________。
(2)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→________(按气流方向,用小写字母表示)。
II.氯气与氨气的反应
室温下,用收集到的氯气与氨气按下图所示装进行实验(实验前K1、K2关闭)。

(3)为使两种气体充分混合,气体a是___________(填化学式)。
(4)
操作步骤 | 实验现象 | 解释原因 |
打开K1,缓缓推动注射器活塞,向试 管中注入气体a (约是气体b的3倍), 关闭K1,恢复室温 | 试管内出现白烟并在 试管内壁凝结 | ①反应的化学方程式________ |
打开K2 | ②_________ | ③_________ |