题目内容
【题目】钛被称为继铁、铝之后的第三金属,在工业上有着广泛而重要的用途。
(1)基态钛原子的价电子排布图为__________________;基态铝原子核外电子分布在____个能级上。
(2)许多金属及其化合物灼烧时会产生特征焰色,产生焰色的原因是______________________。
(3)FeCl3熔点306℃、沸点315℃,CaCl2熔点782℃、沸点1600℃,同是金属氯化物,熔沸点差别很大的原因是________________________________。
(4)煅烧铁矿石常会生成SO2,SO2为_______分子(填“极性”或“非极性”);分子中的大π键可用符号Пnm表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为П66)。推测SO2分子中的大π键可表示为_______________。
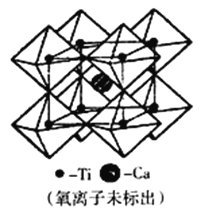
(5)钙钛矿可用来冶炼钛,它的晶胞结构如图所示。钛离子位于立方晶胞的角顶,被____个氧离子包围成配位八面体;钙离子离子位于立方晶胞的体心,被_____个氧离子包围。钙钛矿晶体的化学式为________________________。若该晶胞的边长为apm,则钙钛矿晶体的密度为_____________g·cm-3(用NA表示阿保加德罗常数的值,只要求列算式,不必计算出数值)
【答案】 ![]() 5 当激发态金属原子的电子由高能级跃迁至低能级时,多余能量以光的形式释放就产生了焰色 FeCl3是分子晶体,熔沸点决定于分子间作用力;CaCl2是离子晶体,熔佛点决定于晶格能。分子间作用力远远小于晶格能 极性 П43 6 12 CaTiO3 136/(a3·NA·10-30)
5 当激发态金属原子的电子由高能级跃迁至低能级时,多余能量以光的形式释放就产生了焰色 FeCl3是分子晶体,熔沸点决定于分子间作用力;CaCl2是离子晶体,熔佛点决定于晶格能。分子间作用力远远小于晶格能 极性 П43 6 12 CaTiO3 136/(a3·NA·10-30)
【解析】(1)钛原子核电荷数为22,[Ar]3d24s2,基态钛原子的价电子排布图![]() ;铝原子核电荷数13,核外电子排布为1s22s22p63s23p1,基态铝原子核外电子分布5个能级上;正确答案:
;铝原子核电荷数13,核外电子排布为1s22s22p63s23p1,基态铝原子核外电子分布5个能级上;正确答案: ![]() ; 5。
; 5。
(2)许多金属及其化合物灼烧时会产生特征焰色,产生焰色的原因是当激发态金属原子的电子由高能级跃迁至低能级时,多余能量以光的形式释放就产生了焰色;正确答案:当激发态金属原子的电子由高能级跃迁至低能级时,多余能量以光的形式释放就产生了焰色。
(3)根据信息可知:FeCl3是分子晶体,熔沸点决定于分子间作用力;CaCl2是离子晶体,熔沸点决定于晶格能;而分子间作用力远远小于晶格能,所以二者熔沸点差别很大;正确答案:FeCl3是分子晶体,熔沸点决定于分子间作用力;CaCl2是离子晶体,熔沸点决定于晶格能,分子间作用力远远小于晶格能。
(4)SO2属于sp2杂化,属于角形分子,键角119.5°,属于极性分子;S采取sp2不等性杂化与两个O原子以σ键结合,还有一个p轨道与它们形成三中心4电子大 Π键,因此SO2分子中的大π键可表示为П43 ;正确答案:极性;П43。
(5)钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子包围;每个晶胞中钛离子和钙离子均为1个,晶胞的12个边长上各有一个氧原子,根据均摊原则,每个晶胞实际占有氧原子数目为12×14=3,则晶胞的化学式为CaTiO3;该晶胞的边长为apm,晶胞的体积为(a×10-10)3cm3,1mol晶胞的质量为136g,1mol晶胞的体积为NA×(a×10-10)3cm3,晶体的密度ρ=mV=136g(a×10-10)3NAg·cm-3。正确答案:6; 12; CaTiO3 ;136/(a3·NA·10-30)。

【题目】七水硫酸镁(MgSO4·7H2O)为白色细小四角柱状结晶,无臭,味苦,在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、CaO、B2O3、Al2O3、MnO等)。
表1部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
pH值 | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
表2两种盐的溶解度(单位为g/100g水)
温度/℃ | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | — |
硼镁泥制取七水硫酸镁的工艺流程如下

根据以上流程图并参考表格数据,试回答下列问题:
(1)在酸溶过程中,想加快酸溶速度,提出两种可行的措施_______________。
(2)沉淀A中除二氧化硅外,还含有硼酸(H3BO3),硼酸微溶于水,为一元弱酸,其酸性不来源于羟基的电离,写出硼酸水溶液电离方程式span>_____________________
(3)经对沉淀B进行分析,发现其中含有二氧化锰,用离子方程式解释产生二氧化锰原因:__________________。
(4)加入硼镁泥调节pH=5~6目的是________________。
(5)得到的沉淀C的组成是_________________(填化学式),过滤Ⅲ需趁热过滤,原因是___________。
(6)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是____________。