题目内容
(11分)某化学兴趣小组为了探究锌与硫酸反应的产物,选用了12mol/L的硫酸50ml与过量的锌在加热条件下反应,对硫酸的还原产物进行确定检验。
(1)提出假设。根据所学的知识,他们对硫酸的还原产物提出了三种假设:
假设1:_________________________________;
假设2:_________________________________;
假设3:有SO2与H2 两种气体。
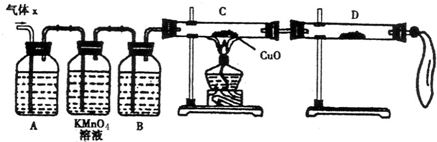
(2)设计实验方案证明假设。小组为了证明假设3,选用了如图所示的仪器与药品,按气流由左至右的方向,仪器的接口顺序为a→
(仪器与药品可重复使用)。
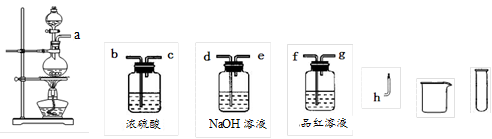
(3)实验过程。根据(2)中的实验方案进行实验。依据所给仪器和条件,要证明有H2产生,应采用的实验操作方法是___________________________________________。
(4)实验结论。通过上述实验,证明确有SO2与H2 两种气体产生。请你从理论上给予合理的解释:_______________________________________________________。
(5)反应停止后,将烧瓶中的液体过滤,滤液用水稀释,加入足量的BaCl2溶液,充分反应后过滤,得到81.55g沉淀。则在该实验中生成的SO2与H2的体积比为__________(同温同压)。
(11分)
(1)只有SO2(或H2)(1分) 只有H2(或SO2(1分))
(2)f→g→d→e→f→g→b→c→h (或f g →d e→ f g →b c →h ) (2分,见错得0分)
(3)用试管从h口收集气体验纯,再于h尖嘴处点燃,并用干燥烧杯罩在火焰上方,若内壁有液滴,证明有氢气产生。(2分,若无验纯,扣1分,其它合理答案参照给分)
(4)开始锌与较浓硫酸反应产生SO2,反应一段时间后,硫酸浓度变小,锌与稀硫酸反应产生H2。(2分)
(5)5:2(3分)
解析:

 名校课堂系列答案
名校课堂系列答案