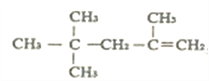
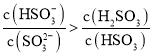题目内容
【题目】下列各项叙述中,正确的是( )
A.氮原子的价电子轨道排布式:![]()
B.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
C.2p和3p轨道形状均为纺锤形,能量也相等
D.钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
【答案】B
【解析】
A选项,氮原子的价电子轨道排布式应该遵循洪特规则:![]() ,故A错误;
,故A错误;
B选项,价电子排布为4s24p3的元素,根据4得出在第四周期,根据s、p轨道上电子数目之和得出在第ⅤA族,是p区元素,故B正确;
C选项,2p和3p轨道形状均为纺锤形,能量不相等,2p轨道能量小于3p轨道能量,故C错误;
D选项,钠原子由1s22s22p63s1→1s22s22p63p1时,原子吸收能量,由基态转化成激发态,故D错误;
综上所述,答案为B。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I.甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1
(1)下列措施中有利于增大该反应的反应速率的是___;
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
(2)已知:CO(g)+2H2(g)![]() CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H2=-283kJ·mol-1
O2(g)=CO2(g) △H2=-283kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) △H3
O2(g)=H2O(g) △H3
化学键 | H—H | O=O | O—H |
键能/KJmol-1 | 436 | 498 | 463.5 |
则△H3=___,表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___;
Ⅱ.当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)其平衡常数表达式为K=____。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是___。
a.体系压强不再改变 b.H2的浓度不再改变
c.气体的密度不随时间改变 d.单位时间内消耗H2和CO2的物质的量之比为3∶1
(3)在一定压强下,测得由CO2制取CH3CH2OH的实验数据中,起始投料比、温度与CO2的转化率的关系如图。根据图中数据
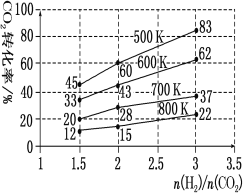
①降低温度,平衡向____方向移动。
②在700K、起始投料比![]() =1.5时,H2的转化率为___。
=1.5时,H2的转化率为___。
③在500K、起始投料比![]() =2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH
=2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH
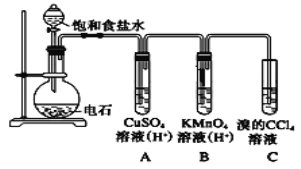
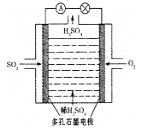
Ⅲ.某学习小组以SO2为原料,采用原电池法制取硫酸。该小组设计的原电池原理如图所示。该电池中右侧为___极,写出该电池负极的电极反应式___。
【题目】现有一瓶A和B的混合液,已知A和B的某些性质如下:
物质 | 分子式 | 熔点℃ | 沸点℃ | 密度 | 水溶性 |
A | C2H6O2 | -98 | 57.5 | 0.93 | 可溶 |
B | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
由此,分离A和B的最佳方法是( )
A.分馏B.升华C.萃取D.分液