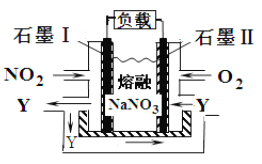
��Ŀ����
����Ŀ��������Ԫ�� a��g �ڱ��е�λ�����ұ�����ش��������⣺

��1��d��eԪ�س������ӵİ뾶�ɴ�С��˳��Ϊ(�û�ѧʽ��ʾ)__________��b��c��Ԫ�طǽ����Խ�ǿ����(дԪ�ط���)_________��д����֤����һ���۵�һ����ѧ����ʽ_____________��
��2�������й�˵����ȷ������___��
A��e�� d2 ��ȼ�գ�����e2d
B�������ۻ�edaʱ������Al2O3���������ô�����
C���� gd2 ͨ����ˮ�У���ˮ��ɫ��������gd2 ��Ư����
D������ĥ���� f ���ھƾ����ϵ�ȼ���۲쵽f �ۻ���δ��Һ�ε���
��3������Ԫ�ؿ������ R��ca4f(gd4)2����S��ca4agd4��
����ͬ�����£�0.1 mol��L��1��R�� c(ca4��) _______(����=���� ��>������<��)0.1 mol��L-1��S��c(ca4��)��
��R��������ˮ������ԭ��Ϊ�������ӷ���ʽ��ʾ��______________��
����ʢ�� 10 mL 1 mol��L-1��S��Һ���ձ��еμ�1 mol��L-1 NaOH��Һ�����ԣ���Ӧ�������Ũ���ɴ�С������˳����_____________��
����ʢ�� 10 mL 1 mol��L-1��R��Һ���ձ��еμ� 1 mol��L-1NaOH��Һ 32 mL�����μ���35 mL��д����ʱ��(32 mL��35 mL)�䷢�������ӷ���ʽ��_____________��
���𰸡� O2��>Na�� N 2HNO3��Na2CO3=2NaNO3��CO2����H2O D < Al3++3H2O![]() Al(OH)3(����) + 3H+ c(Na��)��c(SO42��)��c(NH4��)��c(OH��)��c(H��) NH4����OH��===NH3��H2O
Al(OH)3(����) + 3H+ c(Na��)��c(SO42��)��c(NH4��)��c(OH��)��c(H��) NH4����OH��===NH3��H2O
����������Ԫ�������ڱ���λ�ÿ�֪��aΪH��bΪC��cΪN��dΪO��eΪNa��fΪAl��gΪS��
��1�����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶��O2-��Na+��
ͬ�����������Ԫ�طǽ�������ǿ���ʷǽ�����N��C������������ۺ�������ǿ���Ʊ����������֤����Ӧ����ʽΪ��2HNO3+Na2CO3 =2NaNO3+CO2��+H2O����
��2��A��Na��O2 ��ȼ�գ����ɻ�ɫ��ĩNa2O2����A����B���ڼ����ۻ�״̬�£�NaOH����Al2O3��SiO2��Ӧ�����κ�ˮ��������ۻ�NaOHʱ������Al2O3������Ҳ�����ô���������B����C���� SO2 ͨ����ˮ�У���ˮ��ɫ������SO2 �Ļ�ԭ�ԣ�������Ư���ԣ���C����D����ĥ����Al���ھƾ����ϵ�ȼ�������������������������������������۵��Al�ߣ���۲쵽Al�ۻ���δ��Һ�ε��䣬��D��ȷ����ΪD��
��3����NH4Al��SO4��2��Һ��笠������������������ˮ�⣬��NH4HSO4��Һ������������笠�����ˮ�⣬���������Ƴ̶Ȳ���������Ƴ̶ȴ���NH4HSO4��Һ��笠�����Ũ�ȸ�����ͬ�����£�0.1 mol��L��1��NH4Al��SO4��2�� c(NH4��) <0.1 mol��L-1��NH4HSO4��c(NH4��)��
��NH4Al��SO4��2��������ˮ��������ΪAl3+ˮ�����ɵ������������������������������Ӧ�����ӷ���ʽΪAl3++3H2O![]() Al(OH)3(����) + 3H+��
Al(OH)3(����) + 3H+��
��NH4HSO4�� NaOH�����ʵ���1��1��ӦʱΪ�����ơ�����炙����Һ����Һ�����ԣ�����ϳ����ԣ�����һˮ�ϰ����ɣ�Ϊ�����ơ�����李�һˮ�ϰ������Һ����Ӧ�������Ũ���ɴ�С������˳���ǣ�c��Na+����c��SO42-����c��NH4+����c��OH-��=c��H+����
��10mL 1molL-1 NH4Al��SO4��2��Һ��Al3+ ���ʵ���Ϊ0.01mol��NH4+�����ʵ���Ϊ0.01mol��SO42-�����ʵ���Ϊ0.02mol��32mL 1mol/L NaOH��Һ��NaOH���ʵ���Ϊ0.032L��1mol/L=0.032mol����Al3++3OH-=Al��OH��3������֪��ȫ��������������0.03mol NaOH������NaOH��Һ30mL����NH4++OH-=NH3H2O����֪笠�������ȫ��Ӧ����NaOHΪ0.01mol��������NaOH��Һ10mL���ʼ���32mLNOH��Һ�����μ���35mLʱ��Ӧ���ӷ���ʽΪ��NH4++OH-=NH3H2O��

 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�����Ŀ�������£����и��������У�Y������X��Ӧ������Z��Ӧ����
X | Y | Z | |
�� | NaOH��Һ | Al(OH)3 | ϡ���� |
�� | NaOH��Һ | SO2 | ϡ���� |
�� | O2 | N2 | H2 |
�� | AgNO3��Һ | Cu | Ũ���� |
A. �٢� B. �٢� C. �ڢ� D. �ڢ�