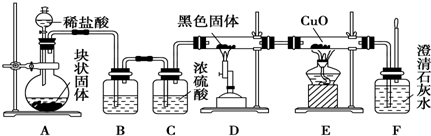
题目内容
3.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | Z2+可影响水的电离平衡 | |
| C. | Y的简单氢化物的热稳定性比W的弱 | |
| D. | Y分别与Z、W形成的化合物中化学键类型相同 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为碳元素;W与X同主族,所以W是Si元素;Y是地壳中含量最高的元素,则Y为氧元素,Z2+与Y2-具有相同的电子层结构,离子核外电子数为10,故Z的质子数为12,则Z为Mg,据此解答.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为碳元素;W与X同主族,所以W是Si元素;Y是地壳中含量最高的元素,则Y为氧元素,Z2+与Y2-具有相同的电子层结构,离子核外电子数为10,故Z的质子数为12,则Z为Mg.
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:r(Mg)>r(Si)>r(C)>r(O),故A错误;
B.Z为Mg,Mg2+在溶液中会水解,所以会影响水的电离平衡,故B正确;
C.元素的非金属性越强,其气态氢化物的稳定性越强,非金属性Y(O)>W(Si),所以Y的气态简单氢化物的热稳定性比W的强,故C错误;
D.Y和Z、W形成的化合物为MgO、SiO2,MgO、SiO2中存在的化学键分别是离子键、共价键,故D错误;
故选B.
点评 本题考查原子结构和元素周期律,明确物质结构、元素周期律即可解答,熟练掌握同一周期、同一主族元素性质递变规律,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
18.下列关于物质或离子检验的叙述正确的是( )
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 在溶液中滴加盐酸酸化,在滴加硝酸钡溶液,若有白色沉淀生成则含有SO42- | |
| C. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| D. | 将气体通入澄清石灰水,溶液变浑浊,证明原气体可能是CO2 |
15.在密闭系统中有反应C(s)+CO2(g)?2CO(g),能使反应速率加快的措施是( )
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎
④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2.
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎
④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2.
| A. | ①②③⑥ | B. | ①②④⑥ | C. | ①②③④ | D. | ①②③④⑤ |
13.相对分子质量为Mr的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为w%,物质的量浓度为c mol•L-1,密度为ρ g•cm-3,则下列说法正确的是( )
| A. | 溶液密度ρ可表示为$\frac{cMr}{1000w}$ | |
| B. | 物质的量浓度c可表示为$\frac{ρV}{MrV+22.4m}$ | |
| C. | 溶液的质量分数w%可表示为$\frac{MrV}{22.4m}$ | |
| D. | 相对分子质量Mr可表示为$\frac{22.4m×w%}{(1-w%)V}$ |