题目内容
某温度下,将 通入KCH溶液中得到KCl、KClO和
通入KCH溶液中得到KCl、KClO和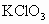 的混合溶液,经测定
的混合溶液,经测定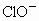 与
与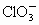 物质的量之比为1∶2,则反应中被氧化的
物质的量之比为1∶2,则反应中被氧化的 与被还原的
与被还原的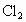 物质的量之比为
物质的量之比为
[ ]
A.3∶11
B.11∶3
C.2∶3
D.4∶3
答案:B
提示:
提示:
|
令溶液中含  1mol,则含 1mol,则含 ,此时被氧化的氯原子为11mol,由氧化还原反应过程中得失电子总数相等,求出被还原的氯原子的物质的量n,则有n ,此时被氧化的氯原子为11mol,由氧化还原反应过程中得失电子总数相等,求出被还原的氯原子的物质的量n,则有n [0-(-1)]=1mol [0-(-1)]=1mol [(+1)-0]+2mol [(+1)-0]+2mol [(+5)-0];n=11mol故被氧化的氯原子与被还原的氯原子的物质的量之比为11∶3. [(+5)-0];n=11mol故被氧化的氯原子与被还原的氯原子的物质的量之比为11∶3. |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
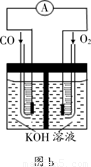
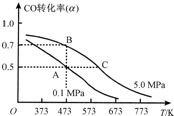 (2013?无锡一模)天然气、煤炭气(CO、H2)的研究在世界上相当普遍.其中天然气和二氧化碳可合成二甲醚,二甲醚与水蒸气制氢气作为燃料电池的氢能源,比其他制氢技术更有优势.主要反应为:
(2013?无锡一模)天然气、煤炭气(CO、H2)的研究在世界上相当普遍.其中天然气和二氧化碳可合成二甲醚,二甲醚与水蒸气制氢气作为燃料电池的氢能源,比其他制氢技术更有优势.主要反应为: CO(g)
+ 3H2(g) ΔH>0
CO(g)
+ 3H2(g) ΔH>0