题目内容
 (2013?无锡一模)天然气、煤炭气(CO、H2)的研究在世界上相当普遍.其中天然气和二氧化碳可合成二甲醚,二甲醚与水蒸气制氢气作为燃料电池的氢能源,比其他制氢技术更有优势.主要反应为:
(2013?无锡一模)天然气、煤炭气(CO、H2)的研究在世界上相当普遍.其中天然气和二氧化碳可合成二甲醚,二甲醚与水蒸气制氢气作为燃料电池的氢能源,比其他制氢技术更有优势.主要反应为:①CH3OCH3(g)+H2O(g)?2CH3OH(g);△H=37kJ?mol-1
②CH3OH(g)+H2O(g)?3H2(g)+CO2(g);△H=49kJ?mol-1
③CO2(g)+H2(g)?CO(g)+H2O(g);△H=41.3kJ?mol-1
其中反应③是主要的副反应,产生的CO对燃料电池Pt电极有不利影响.
请回答下列问题:
(1)二甲醚可以通过天然气和CO2合成制得,该反应的化学方程式为
3CH4+CO2-→2CH3OCH3
3CH4+CO2-→2CH3OCH3
.(2)CH3OCH3(g)与水蒸气制氢气的热化学方程式为
CH3OCH3(g)+3H2O(g)?6H2(g)+2CO2(g)△H=135 kJ?mol-1
CH3OCH3(g)+3H2O(g)?6H2(g)+2CO2(g)△H=135 kJ?mol-1
.(3)下列采取的措施和解释正确的是
ABD
ABD
(填字母).A.反应过程在低温进行,可减少CO的产生
B.增加进水量,有利于二甲醚的转化,并减少CO的产生
C.选择在高温具有较高活性的催化剂,有助于提高反应②CH3OH的转化率
D.体系压强升高,虽然对制取氢气不利,但能减少CO的产生
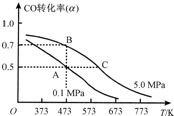
(4)煤炭气在一定条件下可合成燃料电池的另一种重要原料甲醇,反应的化学方程式为CO(g)+2H2(g)?CH3OH(g);△H<0.现将10mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度、压强的关系如图所示.
①自反应开始到达平衡状态所需的时间tA
大于
大于
tB(填“大于”“小于”或“等于”).②A、C两点的平衡常数KA
大于
大于
KC(填“大于”“小于”或“等于”).(5)某工作温度为650℃的熔融盐燃料电池,是以镍合金为电极材料,负极通入煤炭气(CO、H2),正极通入空气与CO2的混合气体,用一定比例的Li2CO3和Na2CO3混合物作电解质.
请写出正极的电极反应式:
O2+4e-+2CO2═2CO32-
O2+4e-+2CO2═2CO32-
.分析:(1)依据原子守恒配平书写化学方程式;
(2)依据热化学方程式结合盖斯定律计算得到;
(3)A、①②③都是吸热反应,低温进行平衡逆向进行,一氧化碳量减少;
B、增加水量,①得到促进,③得到抑制;
C、催化剂改变化学反应速率,不能改变化学平衡;
D、压强增大,②平衡逆向进行,氢气量减小,同时③反应逆向进行减小一氧化碳的产生;
(4)①依据图象变化曲线分析,B点转化率大于A点,需要时间短;
②AC两点转化率相同,温度越高平衡逆向进行,平衡常数越小;
(5)依据原电池原理应用分析判断电极和电极反应;正极是氧气得到电子.
(2)依据热化学方程式结合盖斯定律计算得到;
(3)A、①②③都是吸热反应,低温进行平衡逆向进行,一氧化碳量减少;
B、增加水量,①得到促进,③得到抑制;
C、催化剂改变化学反应速率,不能改变化学平衡;
D、压强增大,②平衡逆向进行,氢气量减小,同时③反应逆向进行减小一氧化碳的产生;
(4)①依据图象变化曲线分析,B点转化率大于A点,需要时间短;
②AC两点转化率相同,温度越高平衡逆向进行,平衡常数越小;
(5)依据原电池原理应用分析判断电极和电极反应;正极是氧气得到电子.
解答:解:(1)二甲醚可以通过天然气和CO2合成制得,反应的化学方程式为:3CH4+CO2-→2CH3OCH3,故答案为:3CH4+CO2-→2CH3OCH3;
(2)①CH3OCH3(g)+H2O(g)?2CH3OH(g)△H=37kJ?mol-1;
②CH3OH(g)+H2O(g)?3H2(g)+CO2(g)△H=49kJ?mol-1;
③CO2(g)+H2(g)?CO(g)+H2O(g)△H=41.3kJ?mol-1;
依据盖斯定律①+②×2得到,CH3OCH3(g)与水蒸气制氢气的热化学方程式为:CH3OCH3(g)+3H2O(g)?6H2(g)+2CO2(g)△H=135 kJ?mol-1;
故答案为:CH3OCH3(g)+3H2O(g)?6H2(g)+2CO2(g)△H=135 kJ?mol-1;
(3)A.反应①②③是吸热反应,反应过程在低温进行,化学平衡逆向进行,一氧化碳减少,可减少CO的产生,故A正确;
B.增加进水量,对反应①起到促进作用,对③起到抑制作用,所以有利于二甲醚的转化,并减少CO的产生,故B正确;
C.选择在高温具有较高活性的催化剂,加快反应速率,但不能改变化学平衡,不能提高反应②CH3OH的转化率,故C错误;
D.体系压强升高,对反应②反应逆向进行,对制取氢气不利,二氧化碳和氢气量减小,对反应③逆向进行,能减少CO的产生,故D正确;
故答案为:ABD;
(4)反应开始至平衡,依据图象分析可知一氧化碳转化率在B点转化率大于A点的转化率,反应速率快,需要时间短,所以tA>tB;AC点转化率相同,但C点温度高于A点,化学平衡是放热反应,升高温度,平衡逆向进行,C点的平衡常数小于A点;即KA>KC,故答案为:大于;大于;
(5)负极通入煤炭气(CO、H2),正极通入空气与CO2的混合气体,用一定比例的Li2CO3和Na2CO3混合物作电解质,正极反应的电极反应为:O2+4e-+2CO2═2CO32-,
故答案为:O2+4e-+2CO2═2CO32-.
(2)①CH3OCH3(g)+H2O(g)?2CH3OH(g)△H=37kJ?mol-1;
②CH3OH(g)+H2O(g)?3H2(g)+CO2(g)△H=49kJ?mol-1;
③CO2(g)+H2(g)?CO(g)+H2O(g)△H=41.3kJ?mol-1;
依据盖斯定律①+②×2得到,CH3OCH3(g)与水蒸气制氢气的热化学方程式为:CH3OCH3(g)+3H2O(g)?6H2(g)+2CO2(g)△H=135 kJ?mol-1;
故答案为:CH3OCH3(g)+3H2O(g)?6H2(g)+2CO2(g)△H=135 kJ?mol-1;
(3)A.反应①②③是吸热反应,反应过程在低温进行,化学平衡逆向进行,一氧化碳减少,可减少CO的产生,故A正确;
B.增加进水量,对反应①起到促进作用,对③起到抑制作用,所以有利于二甲醚的转化,并减少CO的产生,故B正确;
C.选择在高温具有较高活性的催化剂,加快反应速率,但不能改变化学平衡,不能提高反应②CH3OH的转化率,故C错误;
D.体系压强升高,对反应②反应逆向进行,对制取氢气不利,二氧化碳和氢气量减小,对反应③逆向进行,能减少CO的产生,故D正确;
故答案为:ABD;
(4)反应开始至平衡,依据图象分析可知一氧化碳转化率在B点转化率大于A点的转化率,反应速率快,需要时间短,所以tA>tB;AC点转化率相同,但C点温度高于A点,化学平衡是放热反应,升高温度,平衡逆向进行,C点的平衡常数小于A点;即KA>KC,故答案为:大于;大于;
(5)负极通入煤炭气(CO、H2),正极通入空气与CO2的混合气体,用一定比例的Li2CO3和Na2CO3混合物作电解质,正极反应的电极反应为:O2+4e-+2CO2═2CO32-,
故答案为:O2+4e-+2CO2═2CO32-.
点评:本题考查了盖斯定律和热化学方程式的计算应用,化学平衡的影响因素和化学平衡移动原理的分析判断,原电池电极反应的是些方法,图象分析,平衡常数的大小判断是解题关键,题目难度中等.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
