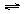题目内容
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:① 2CH3OH(1) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = – 1275.6 kJ/mol
② 2CO(g) + O2(g) = 2CO2(g) ΔH2 = – 566.0 kJ/mol
③ H2O(g) = H2O(1) ΔH3 = – 44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g)
+ 3H2(g) ΔH>0
CO(g)
+ 3H2(g) ΔH>0
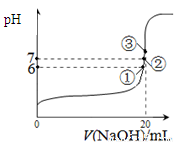
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则Tl ________T2(填“<”、“>”、“=”,下同);A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。
②100℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是__________
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4) = v逆(H2)
如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K =___________
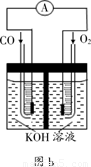
(3)某实验小组利用CO(g) 、 O2(g) 、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为___________。
(共12分)(每空2分)
(1)CH3OH(1) + O2(g) = CO(g) + 2H2O(1) ΔH = –442.8 kJ·mol– 1;
(2)① < ; KC = KB >KA ;
② cd ; 2.25 ;
(3)CO – 2e– + 4 OH- = CO32-+ 2H2O
【解析】
试题分析:
(1)不完全燃烧生成CO 和H2O ,由(①-②)*1/2+2*③得:方程式CH3OH(1) + O2(g) = CO(g) + 2H2O(1) ΔH = –442.8 kJ·mol– 1;
(2)①CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH>0 温度升高,CH4转化率增大,由图,P相等,A——B CH4转化率增大,Tl <
T2。 B和C点温度相同,平衡常数相等。因Tl < T2 ,反应是吸热反应,故有KC = KB >KA 。
CO(g) + 3H2(g) ΔH>0 温度升高,CH4转化率增大,由图,P相等,A——B CH4转化率增大,Tl <
T2。 B和C点温度相同,平衡常数相等。因Tl < T2 ,反应是吸热反应,故有KC = KB >KA 。
②对于前后系数不等的反应,“容器的压强恒定”可做标志。CH4(g) + H2O(g)
 CO(g) + 3H2(g)
CO(g) + 3H2(g)
v正(CH4) : v逆(H2)=1:3 变形有3v正(CH4) = v逆(H2)。
CH4(g) + H2O(g)  CO(g) + 3H2(g)
CO(g) + 3H2(g)
初 1 2 0 0
变 1*0.5 0.5 0.5 3*0.5
平 0.5 1.5 0.5 1.5 K=0.5*1.53/ 0.5* 1.5 = 2.25
(3)总:CO+1/2 O2 +2OH-= CO32-+ H2O 正极:1/2 O2+2 e–= 2OH- 负极=总-正极
负极:得CO – 2e– + 4 OH- = CO32-+ 2H2O 。
考点:本题考查盖斯定律、平衡移动、平衡常数、平衡计算、原电池等知识。

 阅读快车系列答案
阅读快车系列答案