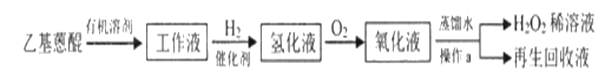
题目内容
【题目】填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:________.
(2)周期表中最活泼的非金属元素位于第________纵行.
(3)A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两种元素的原子核外电子数之和等于B原子的质子数,
![]()
请回答下列问题:写出A、B两种元素的符号:A________,B________.B在周期表中位置是 ________________.
【答案】![]() 17 N S 第三周期第ⅥA族
17 N S 第三周期第ⅥA族![]()
【解析】
(1)质子数为8,该原子为O,根据原子结构表示形式,质量数为8+10=18,即化学符号188O;
(2)同主族从上到下非金属性减弱,同周期从左向右非金属性增强(稀有气体除外),因此非金属性最活泼的非金属元素为F,位于第二周期Ⅶ族,第17纵行;
(3)因三种元素为短周期元素,令A的原子序数为a,则C的原子序数为a+2,B的原子序数为a+9,A、C两种元素的原子核外电子数之和等于B原子的质子数,则有a+a+2=a+9,a=7,即A为N,C为F,B为S,S位于第三周期VIA族;

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目