题目内容
【题目】下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+![]() AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是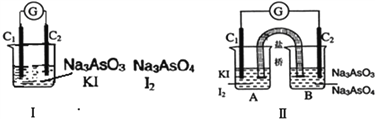
A. 乙组操作时,C2做正极
B. 乙组操作时,C1上发生的电极反应为I2+2e-═2I-
C. 甲组操作时,电流表(G)指针发生偏转
D. 甲组操作时,溶液颜色变深
【答案】B
【解析】甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸,发生氧化还原反应,不发生原电池反应;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液,平衡逆向移动,发生原电池反应,A中发生I2+2e-═2I-,为正极反应,而B中AsO33-转化为AsO43-,As化合价升高,发生氧化反应,C2为负极。A、乙组操作时,C2做负极,故A错误;B、乙组操作时,C1上得到电子,为正极,发生的电极反应为I2+2e-═2I-,故B正确;C、甲组操作时,两个电极均为碳棒,不发生原电池反应,则微安表(G)指针不发生偏转,故C错误;D、发生反应生成碘单质,则溶液颜色加深,故D错误;故选B。

 应用题作业本系列答案
应用题作业本系列答案【题目】某化学兴趣小组的同学通过查阅资料,获得了草酸的一些信息,整理出下表。
结构简式 | HOOC-OOH |
溶解性 | 能溶于水,易溶于乙醇 |
特性 | 大约在157℃升华(175℃以上发生分解) |
化学性质 | H2C2O4+Ca(OH)2=CaC2O4↓+2H2O |
HOOC-COOH | |
2KMnO4+5H2C2O4+3H2SO4= K2SO4+2MnSO4+10CO2↑+8H2O |
(1)该组同学欲通过实验验证草酸受热分解产物中的CO2和CO(装置符合气密性要求,其他试剂可选)。

①填写表中空内。
仪器 | A | B | C |
加入试剂 | ________ | ________ | NaOH溶液 |
②简述检验CO的实验方法和实验现象__________________。
(2)实验室常用草酸钠测定KMnO4溶液的浓度。
①准确称取2.680g草酸钠,溶于稀硫酸和水制成100.0 mL溶液,每次取20.00mL溶液于锥形瓶中;将待测KMnO4溶液置于_______________(填“酸式”或“碱式”)滴定管中进行滴定。重复上述滴定操作三次,实验数椐如下表所示。待测KMnO4溶液的物质的量浓度为____________。
滴定前均为 | 第一次终点 | 第二次终点 | 第三次终点 | |
滴定管液面刻度 | 0.00 mL | 20.02mL | 21.00mL | 19.98mL |
②将酸性KMnO4溶液和H2C2O4溶液混合后,发现开始时溶液褪色不明显,但不久后迅速褪色,针对该实验现象,某同学认为KMnO4溶液与H2C2O4溶液的反应是放热反应,导致溶液温度升高,反应速率加快。你猜想还有可能是_____________的影响。若用实验证明你的猜想,除KMnO4溶液、H2C2O4溶液、稀硫酸外,还需要选择的合理试剂是__________________。


