题目内容
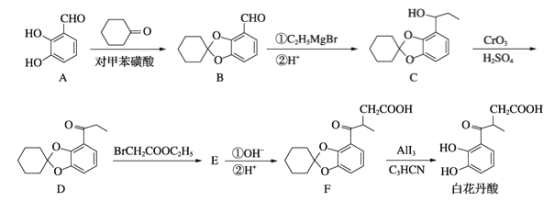
【题目】25℃时,将浓度均为0.1 mol·L-1、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示。下列说法正确的是
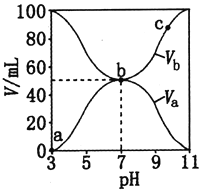
A. Ka(HA)=1×10-6
B. b点时,c(B+)=c(A-)
C. c点时,混合溶液中![]() 随温度升高而增大
随温度升高而增大
D. a→c过程中水的电离程度始终增大
【答案】B
【解析】A. 由图可知0.1mol/L HA溶液pH=3,由HAH++A可知:![]() ,故A错误;B.b点是两者等体积混合溶液呈中性,所以离子浓度的大小为:c(B+)=c(A)>c(H+)=c(OH),故B正确;C.c点时,
,故A错误;B.b点是两者等体积混合溶液呈中性,所以离子浓度的大小为:c(B+)=c(A)>c(H+)=c(OH),故B正确;C.c点时,![]() 水解平衡常数Kh只与温度有关,温度升高,Kh增大,
水解平衡常数Kh只与温度有关,温度升高,Kh增大,![]() 减小,
减小,![]() 减小,故C错误;D.a→b是酸过量和b→c是碱过量两过程中水的电离程受抑制,b点是弱酸弱碱盐水解对水的电离起促进作用,所以a→c过程中水的电离程度先增大后减小,故D错误;本题选B。
减小,故C错误;D.a→b是酸过量和b→c是碱过量两过程中水的电离程受抑制,b点是弱酸弱碱盐水解对水的电离起促进作用,所以a→c过程中水的电离程度先增大后减小,故D错误;本题选B。

练习册系列答案
相关题目
【题目】Ⅰ.有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和黏合剂等高聚物。为研究X的组成与结构,进行了如下实验:
(1)有机物X的质谱图为: | |
| 有机物X的相对分子质量是________。 |
(2)将10.0 g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。 | 有机物X的分子式是______。 |
(3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3∶1。 | 有机物X的结构简式是__________。 |
II.写出与![]() 互为同分异构体,且一溴代物只有两种的芳香烃的结构简式和名称:________________、___________。
互为同分异构体,且一溴代物只有两种的芳香烃的结构简式和名称:________________、___________。