题目内容
8.下列说法不正确的是( )| A. | 由于电流的作用,酸、碱、盐溶于水发生电离 | |
| B. | 胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸,不能透过半透膜 | |
| C. | 存在自由移动的离子是电解质溶液导电的原因 | |
| D. | 向氢氧化铁胶体中滴加稀硫酸,开始时产生沉淀,继续滴加时沉淀溶解 |
分析 A.电解质在水分子作用下电离出阴阳离子;
B、根据胶体的微利大小结合半透膜的特点来回答;
C、溶液导电的原因:存在自由移动的离子;
D、胶体具有聚沉性质,氢氧化铁可以和硫酸之间发生中和反应.
解答 解:A.酸、碱、盐溶于水,在水分子作用下电离出阴阳离子,无需电流作用,故A错误;
B、胶体的分散质粒子直径小于l00nm但大于1nm,该分散系微粒能通过滤纸,不能透过半透膜,故B正确;
C、溶液导电的原因:存在自由移动的离子,故C正确;
D、胶体具有聚沉性质,向氢氧化铁胶体中滴加稀硫酸,开始时产生沉淀,继续滴加时氢氧化铁可以和硫酸之间发生中和反应,沉淀溶解,故D正确.
故选A.
点评 本题考查学生胶体的性质、溶液导电的原因以及电离的有关知识,属于综合知识的考查,难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
18.已知Co2O3在酸性溶液中易被还原成Co2+;且Co2O3、Cl2、FeCl3、I2的氧化性依次减弱.下列反应在水溶液中不可能发生的是( )
| A. | Cl2通入FeI2溶液中,可存在反应3Cl2+6FeI2=2FeCl3+4FeI3 | |
| B. | 每1mol Co2O3在酸性溶液中被还原生成Co2+时转移2 mol e- | |
| C. | FeCl3溶液能使淀粉-KI试纸变蓝 | |
| D. | I2具有较弱的氧化性,不可以将Co2+氧化成Co2O3 |
19.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | Kw/c(H+)=1 mol•L-1的溶液中:Na+、SiO32-、I-、CO32- | |
| B. | 氨水中:Al3+、K+、F-、NO3- | |
| C. | pH=1的溶液中:NH4+、Na+、SO42-、CH3COO- | |
| D. | 0.1 mol•L-1的NaHSO4溶液中:K+、Fe2+、Cl-、NO3- |
16.天津港爆炸现场的氰化钠有剧毒,用过氧化氢处理含氰废水的第一步反应原理如下:CN-+H2O2$\frac{\underline{\;催化剂\;}}{\;}$CNO-+H2O.下列说法正确的是( )
| A. | 反应中H2O2被氧化 | |
| B. | CNO-中N的化合价为-3价 | |
| C. | 温度越高越有利于该反应发生 | |
| D. | 每生成1.8 g H2O,转移电子数为0.4NA |
13.下列实验操作中,错误的是( )
| A. | 蒸馏操作时,冷凝水的方向应当由下往上 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| C. | 蒸馏时,应使温度计水银球位于蒸馏烧瓶的支管口处 | |
| D. | 分液操作时,首先要打开分液漏斗的上口瓶塞,或使瓶塞上的凹槽与上口部的小孔对准,然后进行分液 |
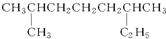 系统命名:2,6二甲基辛烷;
系统命名:2,6二甲基辛烷; ;
; ;②乙醛与银氨溶液水浴加热CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag+3NH3+H2O;
;②乙醛与银氨溶液水浴加热CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag+3NH3+H2O;