题目内容
16.天津港爆炸现场的氰化钠有剧毒,用过氧化氢处理含氰废水的第一步反应原理如下:CN-+H2O2$\frac{\underline{\;催化剂\;}}{\;}$CNO-+H2O.下列说法正确的是( )| A. | 反应中H2O2被氧化 | |
| B. | CNO-中N的化合价为-3价 | |
| C. | 温度越高越有利于该反应发生 | |
| D. | 每生成1.8 g H2O,转移电子数为0.4NA |
分析 CN-+H2O2$\frac{\underline{\;催化剂\;}}{\;}$CNO-+H2O反应中O元素从-1价降低为-2价,C元素从+2价升高到+4价,结合电子转移分析.
解答 解:A.NaCN+H2O2+H2O=NaHCO3+NH3↑反应中O元素从-1价降低为-2价,所以反应中H2O2作氧化剂,被还原,故A错误;
B.NaCN中C为+2价,Na为+1价,则氮元素的化合价为-3,故B正确;
C.过氧化氢受热易分解,温度越高不利于该反应发生,故C错误;
D.每生成1.8 g H2O,即0.1mol,消耗0.1molH2O2,转移电子数为0.2NA,故D错误.
故选B.
点评 本题考查了氧化还原反应,侧重于氧化还原反应电子转移和物质性质的考查,注意从化合价的角度分析,题目难度不大.

练习册系列答案
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
6.某溶液中加入KSCN溶液无明显现象,再通入氯气,溶液立即变为红色,说明原溶液中一定含有( )
| A. | Fe3+ | B. | Fe2+ | C. | Cu2+ | D. | Zn2+ |
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 无色溶液中:Cr2O${\;}_{7}^{2-}$、Fe3+、SCN-、Cl- | |
| B. | 能使石蕊呈蓝色的溶液中:Na+、K+、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012 的溶液中:S2O${\;}_{3}^{2-}$、CrO${\;}_{4}^{2-}$、Cl-、Mg2+ | |
| D. | 水电离的c (H)=10-12mol•L-1 的溶液中:HCO${\;}_{3}^{-}$、SiO${\;}_{3}^{2-}$、Cu2+、NH${\;}_{4}^{+}$ |
4. 铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读如图,K闭合时下列判断不正确的是( )
铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读如图,K闭合时下列判断不正确的是( )
 铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读如图,K闭合时下列判断不正确的是( )
铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读如图,K闭合时下列判断不正确的是( )| A. | d电极:PbSO4+2H2O-2e-=PbO2+4H++SO42- | |
| B. | 当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol | |
| C. | Ⅱ中SO42-向c电极迁移 | |
| D. | K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极 |
11.下列各组离子能大量共存的是( )
| A. | H+、OH-、SO42- | B. | K+、Mg2+,Cl- | ||
| C. | Ca2+,CO32-,OH- | D. | Ba2+,CO32-,SO42- |
8.下列说法不正确的是( )
| A. | 由于电流的作用,酸、碱、盐溶于水发生电离 | |
| B. | 胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸,不能透过半透膜 | |
| C. | 存在自由移动的离子是电解质溶液导电的原因 | |
| D. | 向氢氧化铁胶体中滴加稀硫酸,开始时产生沉淀,继续滴加时沉淀溶解 |
6.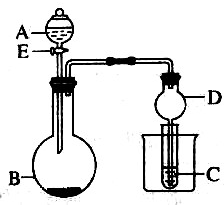 如图所示的装置常用于制取气体并检验气体的性质.下列有关说法正确的是( )
如图所示的装置常用于制取气体并检验气体的性质.下列有关说法正确的是( )
 如图所示的装置常用于制取气体并检验气体的性质.下列有关说法正确的是( )
如图所示的装置常用于制取气体并检验气体的性质.下列有关说法正确的是( )| A. | 关闭分液漏斗的活塞.将干燥管末端放人水中,微热烧瓶,有气泡从水中冒出,停止加热后,燥管内有水柱形成,表明装置不漏气 | |
| B. | 若装置用于制取氯气并验证其具有漂白性,则A中所用试剂为稀盐酸,B中所用药品为KMnO4固体,C中为品红溶液 | |
| C. | 若装置用于制取SO2并验证其具有漂白性,则A中所用试剂为浓硫酸,B中所用药品为Na2SO3固体,C中为酸性KMnO4溶液 | |
| D. | 若实验时B中盛放固体NaOH,A中为浓氨水,C中为稀AgNO3溶液,则实验过程中,C试管中看不到明显的实验现象 |