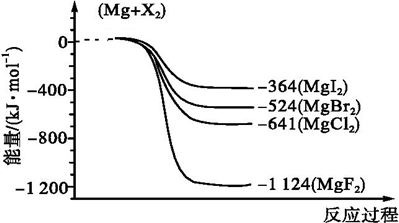
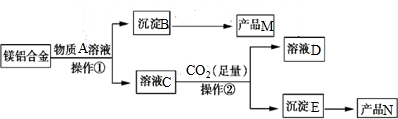
题目内容
20.标准状况下体积约为11.2L的NH3中约含有5mol电子.分析 根据n=VVm计算氨气物质的量,每个氨气分子含有10个电子,电子物质的量为氨气的10倍.
解答 解:标准状况下体积约为11.2L的NH3的物质的量为11.2L22.4L/mol=0.5mol,每个氨气分子含有10个电子,则含有电子物质的量为0.5mol×10=5mol,
故答案为:5.
点评 本题考查物质的量有关计算,关键是对化学式中微粒数目理解,比较简单.

练习册系列答案
相关题目
10.在一定的温度下,下列叙述与图象对应正确的是( )
| A. |  曲线可表示向0.1 mol/L CH3COONa溶液中加水稀释的过程中OH-浓度随溶液体积的变化趋势 | |
| B. | 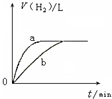 曲线a、b分别表示过量纯锌、过量粗锌(含Cu、C杂质)跟同浓度等体积盐酸反应过程中产生H2体积的变化趋势 | |
| C. |  曲线c、d分别表示等质量的铝分别跟过量烧碱溶液、过量盐酸反应过程中产生H2体积的变化趋势 | |
| D. | 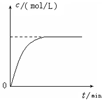 曲线可表示足量锌与一定量稀醋酸反应过程中,Zn2+浓度的变化趋势(假设反应过程中溶液体积保持不变) |
11.下列各组离子能大量共存的是( )
| A. | H+、OH-、SO42- | B. | K+、Mg2+,Cl- | ||
| C. | Ca2+,CO32-,OH- | D. | Ba2+,CO32-,SO42- |
8.下列说法不正确的是( )
| A. | 由于电流的作用,酸、碱、盐溶于水发生电离 | |
| B. | 胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸,不能透过半透膜 | |
| C. | 存在自由移动的离子是电解质溶液导电的原因 | |
| D. | 向氢氧化铁胶体中滴加稀硫酸,开始时产生沉淀,继续滴加时沉淀溶解 |
15.某溶液中大量存在以下浓度的五种离子:0.4mol/L Cl-、0.8mol/L SO42-、0.2mol/L Al3+0.6mol/L H+、M,则M及其物质的量浓度可能为( )
| A. | Na+0.6mol/L | B. | CO32- 0.2 mol/L | C. | Mg2+0.4 mol/L | D. | Ba2+0.4mol/L |