题目内容
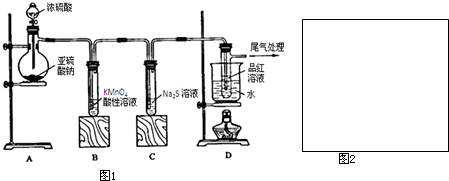
某研究性学习小组按如图所示装置,设计如下实验,其中C中装的是酸性KMnO4溶液,D中为品红溶液,E中为浓硫酸。请你帮助完成下列实验报告,并完成一些问题。
(一)实验目的:研究铁与浓硫酸的反应。
(二)实验药品:铁钉、浓硫酸、酸性KMnO4溶液、品红溶液、CuO、CuSO4溶液。
(三)实验步骤:
实验步骤 | 实验现象 | 结论 |
①连接好装置,并检查装置的气密性 | — | — |
②将铁钉加入到烧瓶中,再向其中滴加浓硫酸 | 未见明显现象 | 原因:____________ |
③点燃A、F处的酒精灯 | 片刻后,烧瓶中溶液的颜色发生变化,并有气泡产生 | 原因:_____________ |
(四)完成下列问题:
(1)盛放药品前,检查此装置气密性的操作方法和现象是___________________________。
(2)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为____________________________。
(3)装置G烧杯中盛放的液体是______________________________________,其作用是__________________________________________________。
(4)装置B的作用是贮存多余的SO2和防止其污染环境,则B中应盛放的液体是_______。
A.水 B.浓溴水 C.酸性KMnO4溶液 D.饱和NaHSO3溶液
(五)实验探究:
在实验过程中,该学生观察到C装置中颜色逐渐变浅,D装置中溶液颜色未见明显变化,再过一段时间后,F装置中CuO粉末由黑色转变为红色,烧杯G中逐渐冒出气泡,此时D装置中溶液颜色仍未见明显变化。
(1)F装置中CuO粉末由黑色转变为红色的原因是________________________________。
(2)为了验证铁钉与浓硫酸在不加热时是否发生反应,可采用的方法是________________。
(三)②铁遇冷的浓硫酸发生钝化,阻止铁与浓硫酸继续反应
③加热使铁表面的氧化物薄膜被破坏并发生反应,溶液中有Fe3+生成,并伴随有SO2气体产生
(四)(1)将G装置中导管口浸没在液面下,关闭分液漏斗活塞,打开K,微热A装置,G装置中导管有气泡冒出;关闭K,B装置中长颈漏斗中液面上升(B瓶中液面下降),说明装置不漏气
(2)2Fe+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+6H2O
Fe2(SO4)3+3SO2↑+6H2O
(3)碱液 防止多余的SO2气体逸出污染环境
(4)D
(五)(1)A装置中浓硫酸在加热的条件下与铁反应逐渐变为稀硫酸,发生置换反应:Fe+H2SO4![]() FeSO4+H2↑,生成的H2经过F装置还原氧化铜:CuO+H2
FeSO4+H2↑,生成的H2经过F装置还原氧化铜:CuO+H2![]() Cu+H2O
Cu+H2O
(2)将铁钉放置在冷的浓硫酸中浸泡一段时间后,取出铁钉置于硫酸铜溶液中,观察铁钉表面是否有铜析出。若没有红色的铜析出,则表明在不加热时,铁钉与浓硫酸发生反应,否则铁钉与浓硫酸不发生反应(或其他合理方案)
解析:本题是一道有关浓硫酸的探究性实验题,难点在问题的探究部分。
铁在冷的浓硫酸中能发生钝化,加热时浓硫酸能将铁氧化,反应产生还原性的SO2,SO2在水中的溶解度较大,能被溴水和酸性KMnO4溶液氧化。B装置中通过排液体贮存SO2应该选用饱和NaHSO3溶液。装置C是用来除去SO2的,装置D是用来检验SO2是否除尽的,装置E是用来吸收水蒸气的。实验中D中的品红溶液未明显褪色,说明没有SO2进入装有CuO的玻璃管,使CuO被还原的气体只能是H2,由此可以想到实验中浓硫酸变成了稀硫酸。
若铁与浓硫酸在不加热时发生反应,因钝化会使铁的表面形成致密的氧化物保护膜,铁将不能与CuSO4等发生置换反应;反之能与CuSO4等发生置换反应。据此可设计实验方案。

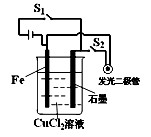
某研究性学习小组用如图所示装置研究不同能量之间的转化问题。
下列说法正确的是( )
| A.断开开关S1,按下开关S2,此时构成的装置属于电解池 |
| B.断开开关S1,按下开关S2,化学能转化为电能,电能转化为光能等 |
| C.断开开关S2,按下开关S1,此时构成的装置属于原电池 |
| D.断开开关S2,按下开关S1,化学能转化为电能 |