题目内容
19.现有A、B、C、D化合物形成的四种溶液,它们所含有阳离子和阴离子如表:| 阳离子 | Ba2+、Ag+、Na+、Mg2+ |
| 阴离子 | NO3-、CO32-、OH-、HCO3- |
①A、B两种溶液都与盐酸反应,都有气泡产生,相同物质的量的A、B两种物质,A含有的阴离子数大于B.
②C溶液呈强碱性.
请回答下列问题:
(1)请写出A、B、C、D四种物质的化学式:AMg(HCO3)2BNa2CO3CBa(OH)2DAgNO3
(2)请写出下列反应的离子方程式:
①A和足量的氢氧化钠溶液的反应:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
②B和足量醋酸溶液的反应:CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O
③C和少量的硫酸溶液反的应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
④C和少量碳酸氢钠溶液的反应:HCO3-+Ba2++OH-=BaCO3↓+H2O
⑤D和盐酸的反应:Ag++Cl-=AgCl↓.
分析 A、B两种溶液都与盐酸反应,都有气泡产生,说明A、B中含有CO32-、HCO3-,根据题中提供的离子,碳酸根离子只能与钠离子共存,所以氢氧根离子只能与钡离子形成溶液,相同物质的量的A、B两种物质,A含有的阴离子数大于B,则A为Mg(HCO3)2,B为Na2CO3,C溶液呈强碱性,则C应含有OH-,所以C为Ba(OH)2,综合各离子可知,D为AgNO3,据此答题.
解答 解:A、B两种溶液都与盐酸反应,都有气泡产生,说明A、B中含有CO32-、HCO3-,根据题中提供的离子,碳酸根离子只能与钠离子共存,所以氢氧根离子只能与钡离子形成溶液,相同物质的量的A、B两种物质,A含有的阴离子数大于B,则A为Mg(HCO3)2,B为Na2CO3,C溶液呈强碱性,则C应含有OH-,所以C为Ba(OH)2,综合各离子可知,D为AgNO3,
(1)根据上面的分析可知,A为Mg(HCO3)2,B为Na2CO3,C为Ba(OH)2,D为AgNO3,
故答案为:Mg(HCO3)2;Na2CO3;Ba(OH)2;AgNO3;
(2)①A为Mg(HCO3)2,A和足量的氢氧化钠溶液反应的离子方程式为Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O,
故答案为:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O;
②B为Na2CO3,B和足量醋酸溶液的反应的离子方程式为CO32-+2CH3COOH=CO2↑+2 CH3COO-+H2O,
故答案为:CO32-+2CH3COOH=CO2↑+2 CH3COO-+H2O;
③C为Ba(OH)2,C和少量的硫酸溶液反应的离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,
故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
④C为Ba(OH)2,C和少量碳酸氢钠溶液的反应的离子方程式为HCO3-+Ba2++OH-=BaCO3↓+H2O,
故答案为:HCO3-+Ba2++OH-=BaCO3↓+H2O;
⑤D为AgNO3,D和盐酸的反应的离子方程式为Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓.
点评 本题考查了常见离子的检验及离子共存,注意掌握离子反应的书写方法,该题是高考中的常见题型,属于中等难度的试题.

| A. | 蒸馏实验时,应将温度计水银球置于蒸馏烧瓶支管口处 | |
| B. | 蒸馏实验时,冷水从冷凝管下口入,上口出 | |
| C. | 萃取使用的主要仪器是分液漏斗,在使用前要先检验其是否漏液 | |
| D. | 萃取实验时,应先后将上下两层液体从下口放出,并用不同烧杯盛放 |
| A. | 由水电离产生的c(H+)=10-12 mol•L一1的溶液中:K+、Na+、Fe2+、NO3- | |
| B. | pH=7的溶液中:Al3+、Cl-、HCO3-、SO42- | |
| C. | pH=13的溶液中:K+、Ba2+、Cl-、OH- | |
| D. | pH=13的溶液中:NH4+、Na+、HS-、Cl- |
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | H2SO4既不是氧化剂又不是还原剂 | |
| D. | 反应中KCl被还原 |
 (1)过氧化氢是一种二元弱酸,比碳酸的酸性还弱.
(1)过氧化氢是一种二元弱酸,比碳酸的酸性还弱.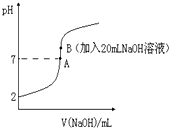 氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF?H++F-.25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示.
氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF?H++F-.25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示. 实验室常用以下方法制取氯气:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,
实验室常用以下方法制取氯气:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O, .
.