题目内容
右图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
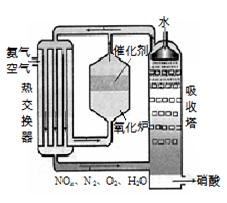
①4NH3(g)+5O2(g) 4NO(g) +6H2O(l) △H<0
4NO(g) +6H2O(l) △H<0
②2NO(g)+O2 (g) 2NO2(g) △H<0
2NO2(g) △H<0
③3NO2(g)+H2O(l) 2HNO3(l) +NO(g) △H<0
2HNO3(l) +NO(g) △H<0
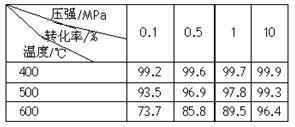
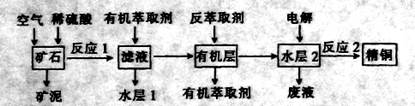
⑴能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 ▲ 。
⑵在2L密闭容器内充入0.50 mol NO和0.25 mol O2,维持反应温度为800℃,当反应达到平衡时,NO的转化率为50%。则800℃时反应2NO+O2=2NO2的平衡常数K= ▲ 。
⑶某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/c m3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
m3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是 ▲ 。
②每小时从吸收塔淋下的水的质量应是多少吨?(写出计算过程)

①4NH3(g)+5O2(g)
 4NO(g) +6H2O(l) △H<0
4NO(g) +6H2O(l) △H<0②2NO(g)+O2 (g)
 2NO2(g) △H<0
2NO2(g) △H<0③3NO2(g)+H2O(l)
 2HNO3(l) +NO(g) △H<0
2HNO3(l) +NO(g) △H<0⑴能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 ▲ 。
| A.适当升高温度 |
| B.适当增大吸收塔内的压强 |
| C.增大空气中O2的浓度 |
| D.吸收塔内填充瓷环,增大气液接触面 |
⑶某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/c
 m3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
m3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是 ▲ 。
②每小时从吸收塔淋下的水的质量应是多少吨?(写出计算过程)
⑴BC ⑵16(每空2分,共4分)
⑶①14 mol/L (3分)
②每小时生成的硝酸的质量m(HNO3)=" 20" t×63%="12.6" t
根据总化学方程式:NH3+2O2=HNO3+H2O
每小时生成水m(H2O)1=" 12.6" t×18/63="3.6" t
生成的硝酸中所含水的质量m(H2O)=" 20" t-12.6 t="7.4" t
每小时从吸收塔淋下的水的质量m(H2O)2=" 7.4" t -3.6 t="3.8" t (3分)
⑶①14 mol/L (3分)
②每小时生成的硝酸的质量m(HNO3)=" 20" t×63%="12.6" t
根据总化学方程式:NH3+2O2=HNO3+H2O
每小时生成水m(H2O)1=" 12.6" t×18/63="3.6" t
生成的硝酸中所含水的质量m(H2O)=" 20" t-12.6 t="7.4" t
每小时从吸收塔淋下的水的质量m(H2O)2=" 7.4" t -3.6 t="3.8" t (3分)
略

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
 N2(g)+3H2(g)
N2(g)+3H2(g)  2NH3(g);△H= -92.4kJ/mol
2NH3(g);△H= -92.4kJ/mol